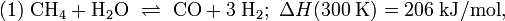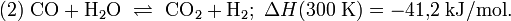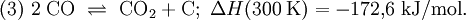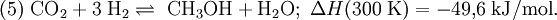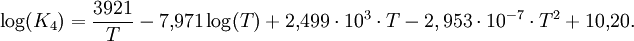- CH3OH
-
Strukturformel 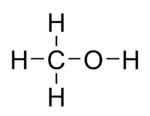
Allgemeines Name Methanol Andere Namen - Methylalkohol
- Karbinol
- Holzgeist
- MeOH
- S-747 (NATO-Code)
Summenformel CH3OH oder CH4O CAS-Nummer 67-56-1 PubChem 887 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 32,04 g·mol−1 Aggregatzustand flüssig
Dichte 0,79 g·cm−3[1]
Schmelzpunkt Siedepunkt 65 °C[1]
Dampfdruck Löslichkeit mischbar mit Wasser[1], gut in polaren, schlecht in unpolaren Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Leicht-
entzündlich(T) (F) R- und S-Sätze R: 11-23/24/25-39/23/24/25 S: (1/2)-7-16-36/37-45 MAK 200 ml·m−3, 270 mg3[1]
WGK 1[1] Thermodynamische Eigenschaften ΔHf0 −75 kJ·mol−1
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Methanol ist ein einwertiger Alkohol, der sich vom einfachsten Alkan Methan durch Ersetzung eines Wasserstoffatoms durch die Hydroxylgruppe ableitet. In der Natur kommt er in Baumwollpflanzen, Heracleum-Früchten, Gräsern und in ätherischen Ölen vor. Methanol entsteht auch bei Gärungsvorgängen, z. B. von Zuckerrohrsaft. Bei der Vergärung von Früchten können die darin enthaltenen Pektine u. a. zu Methanol abgebaut werden. Der Konsum von Methanol, z. B. als Bestandteil von selbstgebrannten Alkoholika, führt zu schweren Vergiftungen. In käuflichen alkoholischen Getränken ist aber kaum Methanol enthalten, da Prozessführung, Destillation sowie Lebensmittelkontrollen für ein hohes Maß an Sicherheit sorgen.
Inhaltsverzeichnis
Geschichte
Schon in der Antike benutzten die Ägypter zur Balsamierung ihrer Toten ein Substanzgemisch, das unter anderem Methanol enthielt.
Im Jahr 1661 konnte Robert Boyle das Methanol aus Holzessig gewinnen. Elementaranalytische Methoden waren in diesem frühen Stadium der Chemie jedoch noch nicht entwickelt.
1834 wurde schließlich die elementare Zusammensetzung von Methanol von den französischen Chemikern Jean Baptiste Dumas und Eugene Peligot geklärt. Sie gaben der Substanz den Namen „methylene“. Methylene ist eine Zusammensetzung aus den griechischen Worten méthy (Wein) und hylé (Holz). Die ersten großtechnischen Methanolsynthesen erfolgten durch eine trockene Destillation von Holz. Noch im Jahr 1930 wurde in den USA 50 % des Methanols nach diesem Verfahren gewonnen.
1923 entwickelte Matthias Pier für die BASF einen Prozess, um aus Kohle und Wasserstoff Methanol zu synthetisieren. 1923 begann die erste Großproduktion in den Leuna-Werken, dem Ammoniakwerk Merseburg. Dieser Prozess basierte auf einem Zink-Chrom-Katalysator, extrem hohen Drücken und Temperaturen. In modernen Methanolsynthesen werden effizientere Katalysatoren eingesetzt, welche die Verwendung von moderateren Temperaturen und Drücken erlauben.
Von der Firma ICI wurde im Jahr 1966 die erste Niederdrucksynthese mit einem Kupferoxid-Zinkoxid–Aluminium-Katalysator durchgeführt. Fast alle späteren Niederdruckkatalysatoren nutzten ebenfalls die preisgünstigen Grundstoffe Kupfer, Zink, Aluminium. Die Mehrzahl der Anlagenneubauten seit den siebziger Jahren erfolgte dann für das Niederdruckverfahren; sie nutzen als Ausgangsstoff fast ausschließlich Erdgas.
Herstellung
Grundlagen
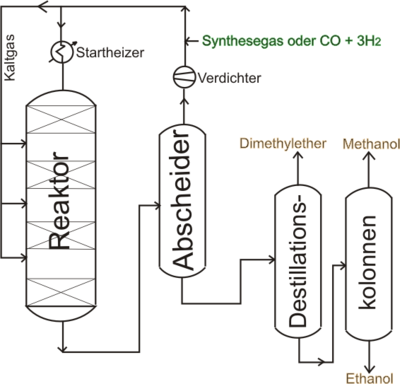
Historisch wurde Methanol schon im 17. Jahrhundert durch trockene Destillation (= Erhitzen unter Luftabschluss, Pyrolyse) von Laubholz (daher der Trivialname Holzgeist) gewonnen. Im Holzdestillat befanden sich etwa 1,5–3 % Methanol, 10 % Essigsäure, 0,5 % Aceton, Essigsäuremethylester, Acetaldehyd, Holzteer und im Gasgemisch Wasserstoff, Kohlenstoffmonoxid und Ethen. Die entstandene Essigsäure lässt sich in guten Ausbeuten (ca. 80%) anodisch zu Methanol oxidieren. Heutzutage wird Methanol großtechnisch aus Synthesegas hergestellt. Als Nebenprodukte fallen Ethanol und Dimethylether an.
Die Weltjahresproduktion lag im Jahr 2005 bei etwa 30 Millionen Tonnen. Die größten Hersteller sind die Methanex Corporation mit einer Jahresproduktion von 5,3 Millionen Tonnen mit Sitz in Vancouver, Kanada, und die Methanol Holdings (Trinidad) Ltd. in Trinidad mit einer Produktionsmenge von 4 Millionen t/a (Stand 2005).[3][4] In Großanlagen werden aus Erdgas täglich 5.000 bis 10.000 Tonnen Methanol erzeugt.
Die aktuellen Verfahren zur Herstellung von Methanol unterscheiden sich durch den Reaktionsdruck. Die Verfahren können wie folgt klassifiziert werden:
- Hochdruckverfahren, 250–350 bar, 320–380 °C.
- Mitteldruckverfahren, 100–250 bar, 220–300 °C.
- Niederdruckverfahren, 50–100 bar, 200–300 °C.
Am wichtigsten ist das Niederdruckverfahren, das in der Regel bei 230–250 °C ausgeführt wird.
Als Rohstoffe für die Methanolherstellung können Erdgas, Benzin, Rückstandsöle der Erdölaufarbeitung, Kohle oder auch Kohlenstoffdioxid und Wasserstoff verwendet werden. Bislang ist der wichtigste Grundstoff das Erdgas.
Herstellung von Methanol aus Erdgas
Erdgas besteht fast vollständig aus Methan. Vor der Reaktion müssen vom Erdgas alle Bestandteile entfernt werden, die den Katalysator für die Reaktion zerstören könnten. Der Schwefelwasserstoffgehalt muss unter 0,1 ppm liegen. Unter katalytischem Einfluss kann sich Methan und Wasserdampf zu Kohlenstoffmonoxid und Wasserstoff umsetzen.
Die Reaktion (1) von Methan und Wasser zu Kohlenstoffmonoxid und Wasserstoff ist endotherm, d. h. es muss Energie zugeführt werden, damit der Prozess in Richtung Kohlenstoffmonoxidbildung abläuft. Das Methangas muss auf etwa 420 bis 550 °C vorgeheizt werden und wird dann durch Röhren geleitet, die mit Nickel imprägniert sind. Der Prozess der Umwandlung von Methan zu Kohlenstoffmonoxid und Wasserstoff heißt Reformierung. Da nach Gleichung (1) aus zwei Molekülen vier Moleküle entstehen, begünstigt ein niedriger Druck diese Reaktion (Prinzip von Le Chatelier); Eine Druckerhöhung würde die Rückreaktion in Richtung Methan begünstigen. Das Kohlenstoffmonoxid reagiert nach (2) (Wassergas-Shift-Reaktion) weiter mit Wasserdampf, so dass sich neben Kohlenstoffmonoxid zusätzlich auch Kohlenstoffdioxid bildet.
Hohe Temperaturen begünstigen die Verschiebung des sogenannten Boudouard-Gleichgewichts nach links, welches sich zwischen Kohlenstoffmonoxid auf der linken, Kohlenstoffdioxid und Kohlenstoff auf der rechten Seite einstellt:
Für die Bildung von Methanol aus Kohlenstoffmonoxid oder Kohlenstoffdioxid und Wasserstoff können die folgenden Gleichungen formuliert werden:
Diese beiden Reaktionen sind exotherm, d. h. die Wärmeentwicklung während der Reaktion kann für die Durchführung der Niederdruckkatalyse bei etwa 250 °C genutzt werden. Nach den Gleichungen entstehen aus drei bzw. aus vier Molekülen eines bzw. zwei. Nach dem Prinzip von Le Chatelier führt also eine Druckerhöhung zu einer Verschiebung des Gleichgewichtes nach rechts.
Für die Temperaturabhängigkeit der Gleichgewichtskonstanten der Reaktion (4) gilt die folgende Beziehung:
Mit dieser Gleichung lässt sich die Methanolbildung bei verschiedenen Reaktionstemperaturen berechnen.
Methanolproduktion in 1000 t:
Jahr USA Deutschland Welt Verkaufspreis ($/t) 1928 24 18 k. A. k. A. 1936 97 93 k. A. k. A. 1950 360 120 k. A. k. A. 1960 892 297 k. A. 99,7 1970 2238 k.A. 5000 89,7 1980 3176 870 15000 236,1 2004 3700 2000 32000 270 LPMEOH-Verfahren
In den USA wurde Anfang der achtziger Jahre ein Programm „Saubere Kohle-Technologie“ (Clean Coal Technology = CCT) zur Verbesserung von Kohletechnologien aufgelegt. Dieses Programm hatte zum Ziel, die Kohlenstoffdioxidemissionen bei der Kohlevergasung drastisch zu senken.
Im Zusammenhang mit dem Projekt wurde eine Anlage zur Methanolherstellung (LPMEOH-Verfahren[5]) aus Synthesegas von den Firmen Eastman Chemical Company und Air Products entwickelt. Schon im Jahre 1983 errichtete Eastman Chemical Company in Kingsport, Tennessee, eine Kohlevergasungsanlage. Mit dieser Anlage können 1000 Tonnen Kohle pro Tag in Synthesegas umgewandelt werden.
Die erste LPMEOH-Anlage wurde zwischen Oktober 1995 und Januar 1997 fertiggestellt. Im LPMEOH-Reaktor befindet sich der Katalysator in einem hochsiedendem Mineralöl (30 % Katalysator auf 70 % Mineralöl). In den Reaktor wird nun von unten Synthesegas eingeleitet. Bei etwa 235 °C bildet sich im Reaktor Methanol, das in Dampfform zusammen mit dem nicht umgesetzten Synthesegas den Reaktor wieder verlässt. Nach Abkühlung, Abtrennung und Reinigung durch Destillation erhält man reines Methanol. Der Katalysator verliert pro Tag etwa 0,2 % an Aktivität und muss nach längerem Gebrauch ersetzt werden. In der Anfangsphase wurden 260 bis 300 Tonnen Methanol/Tag hergestellt. Die Baukosten für die LPMEOH-Anlage wurden mit 214 Millionen Dollar angegeben, die Herstellungskosten pro Gallone Methanol aus Kohle mit 0,50 $. Dies entspricht etwa 168 Dollar/Tonne oder 0,168 Dollar/Kilogramm.
Nach Angaben des Chemieanlagenherstellers Lurgi[6] liegen die Herstellungskosten von Methanol auf der Basis von Erdgas derzeit zwischen 50 und 110 US-$/Tonne.
Ausblick
Dem Chemiker und Nobelpreisträger George Olah zufolge sind mittlerweile Verfahren entwickelt, mit denen Methanol direkt und ohne Synthesegas aus Methan hergestellt werden kann. Des Weiteren, so Olah, könne man Methanol auch aus CO2 und Wasser unter Zuführung von elektrischem Strom herstellen; so sei ein „Recycling“ von CO2 möglich.[7]. (Vergleiche auch Methanolwirtschaft). Auf diesem Gebiet liegt bereits eine Vielzahl von Patenten vor, die aufzeigen, dass dies möglich ist. Das gegenwärtige Problem besteht darin, die notwendigen hohen Stromdichten für eine Großproduktion zu erzielen. Wirtschaftlich und energiepolitisch sind solche Verfahren jedoch äußerst fragwürdig, weil für das CO2-Recycling mehr Energie aufgebracht werden müsste als bei der vorhergehenden Verbrennung von C zu CO2 gewonnen würde. Methanol kann allerdings sowohl Benzin als Treibstoff ersetzen, als auch zu Benzin hinzugemischt werden, ist dabei erheblich effizienter und kostengünstiger zu speichern als Wasserstoff, und wird deswegen als zukünftiger Ersatz für fossile Treibstoffe diskutiert.
Japanische Wissenschaftler haben inzwischen einen verbesserten Katalysator für die Methanolsynthese entwickelt (Patentschrift DE 69808983 T2)[8]. Die Wissenschaftler beobachteten einen zwei- bis dreifach höheren Umsatz gegenüber herkömmlichen Katalysatoren bei der Umsetzung von Kohlenstoffdioxid und Wasserstoff zu Methanol. Sie heben in ihrer Patentschrift hervor, dass es mit verbesserten Katalysatoren möglich sein sollte, die globale Erwärmung durch Kohlenstoffdioxid zu lindern. Wasserstoff kann durch Elektrolyse von Wasser (vielleicht zukünftig aus Strom von erneuerbaren Energien oder durch Fusionsenergie) oder durch starke Erhitzung von Wasserdampf und Abtrennung des Wasserstoffs erzeugt werden. Ob die Gewinnung des Kohlenstoffdioxids (zum Einsatz für die Methanolsynthese) aus Abgasen oder aus der Luft jedoch wirtschaftlich ist, bleibt fraglich.
Schallgeschwindigkeit 1103 m·s−1 (25 °C) Oberflächenspannung 0,0226 N·m−1 (20 °C gegen Luft) Energiedichte pro kg 5,47 kWh·kg−1 = 19,70 MJ·kg−1 Energiedichte pro Liter 4,4 kWh·l−1 = 15,84 MJ·l−1 dynamische Viskosität 0,59 · 10−3 Pa·s (20 °C) Dielektrizitätskonstante 32,63 = εr (25 °C) Brechungsindex 1,326 (25 °C, Na-D-Linie) Isotherme Kompressibilität 12·10-5 bar−1 (20 °C) Wärmekapazität 2,54 kJ·kg−1·K−1 (25 °C) Physikalische und chemische Eigenschaften
Auf Grund der polaren Hydroxylgruppe lässt sich Methanol mit Wasser in jedem Verhältnis mischen. Die Ähnlichkeit zu Wasser zeigt sich auch im Lösungsvermögen von einigen Mineralsalzen in Methanol (Calciumchlorid, Kupfersulfat). Es ist ferner in Diethylether und anderen organischen Lösungsmitteln (auch in Kohlenwasserstoffen unter Wasserausschluss) gut löslich. Nicht löslich ist Methanol in Fetten und Ölen.
Methanol verbrennt mit blauer, fast unsichtbarer Flamme. Der Flammpunkt liegt bei 9 °C. Methanoldämpfe bilden mit Luft explosionsfähige Gemische.
Die UN-Nummer von Methanol ist 1230, die Gefahrnummer 336. Methanol hat einen Spezifischen Heizwert von 19.700 kJ·kg−1 und eine Energiedichte von 4,4 kWh·l−1.
Anwendung
Kraftstoff
Methanol-Kraftstoff Andere Namen M100, Methol, Spritol, Methyloxyhydrat, Methynol, Pyroholzether, Spiritol, Holzin, Holzalkohol, Holzspiritus, Karbinol, Holzgeist, Carbinol, Methylalkohol [1]
Kurzbeschreibung Ottokraftstoff für angepasste Motoren Charakteristische Bestandteile Methanol
CAS-Nummer 67-56-1
Eigenschaften Aggregatzustand flüssig Dichte 0,79 kg/L [1]
Heizwert 5,1 kWh/L = 6,49 kWh/kg
Brennwert 17,9 MJ/L = 22,7 MJ/kg
Oktanzahl 160 ROZ [9]
Schmelzbereich −98 °C [1] Siedebereich 65 °C [1]
Flammpunkt 9 °C [1]
Zündtemperatur 440 °C [1] Explosionsgrenze 6–50 Vol.-% [1] Temperaturklasse T2 [1] Sicherheitshinweise UN-Nummer 1230 [1] Gefahrnummer 336 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Methanol kann in vielfältigen Varianten entweder direkt als Kraftstoff, als Kraftstoffzusatz oder als Derivat eingesetzt werden:
- Zur Gewinnung elektrischer Energie in einer Direktmethanol-Brennstoffzelle. Diese befinden sich heute allerdings noch im Entwicklungsstadium. Alternativ kann Methanol in einem Reformer in ein wasserstoffreiches Gasgemisch und CO2 zerlegt werden. Der entstehende Wasserstoff wird dann einer normalen Brennstoffzelle verarbeitet.
Zum Einsatz in Otto- und Diesel-Verbrennungsmotoren sind heute folgende Möglichkeiten bekannt:
- Nach der Europäischen Norm für Ottokraftstoffe EN 228 sind maximale Zumischungen von 3 Vol% zum Kraftstoff zulässig (mit zusätzlichem Stabilisierungsmittel). Derartige geringe Zumischungen können von heutigen Ottomotoren ohne Anpassungen verkraftet werden. Aus Kostengründen wurden bisher diese Möglichkeiten in Deutschland aber nicht ausgenutzt.
- Als Zumischungen in höheren Konzentrationen zum Benzin oder als nahezu reiner Methanolkraftstoff. In einem vom Bundesministerium für Forschung und Technologie gesponserten Großversuch in Deutschland wurden in den 80er Jahren ein M15-Kraftstoff, bestehend aus 15% Methanol und 85% Benzin, und ein M85-Kraftstoff, bestehend aus 85% Methanol und 15% Benzin, mit über 1000 Fahrzeugen aller deutschen Autohersteller mit Unterstützung der Mineralölindustrie sowie zahlreicher Forschungsinstitute ausführlich getestet. Die Fahrzeuge wurden für den Betrieb mit diesen Kraftstoffen werkstoff- und gemischbildungsseitig entsprechend angepasst. Ähnliche Versuche wurden u.a. in USA, Japan, China, Neuseeland und Südafrika durchgeführt.
- Ebenfalls wurde in diesem Programm ein Methanol-Diesel-Mischkraftstoff mit 20 % Methanol in PKW getestet.
- Für die Verwendung von reinem Methanol (M100) wurden Nutzfahrzeug-Dieselmotoren entsprechend modifiziert. Wegen der niedrigen Cetanzahl von Methanol ist ein Motorbetrieb als Selbstzünder nicht möglich, deshalb wurden zusätzliche Zündhilfen in Form von Diesel-Piloteinspritzung oder Kerzen- bzw. Glühzündung eingesetzt. Auch ein Zweistoffbetrieb Diesel-Methanol ist möglich.
- Universeller Einsatz unterschiedlicher Konzentrationen in Flexible Fuel Vehicle
- Durch Reaktion mit bestimmten Kohlenwasserstoffen lassen sich Alkohole in andere sauerstoffhaltige Komponenten umwandeln, die ebenfalls als Kraftstoff oder Mischkomponente eingesetzt werden können. Von besonderem Interesse ist der aus Methanol und Isobuten gewonnene Methyl-tert-butylether (MTBE), der zur Erhöhung der Klopffestigkeit dem Ottokraftstoff zugemischt wird. Wegen seiner umweltkritischen Eigenschaften wird MTBE jedoch zunehmend durch Ethanol ersetzt.
- Durch Umesterung von Pflanzenölen mit Methanol werden Fettsäuremethylester erzeugt, wobei Nebenprodukte wie Glycerin anfallen. Bekannt geworden ist der Rapsölmethylester (RME), der schon seit längerem als Kraftstoff in Dieselmotoren eingesetzt wird (Biodiesel).
- Durch das MTG-Verfahren (Methanol to Gasoline) kann Methanol zu hochoktanigem Ottokraftstoffen umgewandelt werden. Es kann auf diese Weise auch in konventionellen Motoren eingesetzt werden. Eine Pilotanlage mit einer Produktionsleistung von 1.700 Tonnen Kraftstoff pro Tag wurde bereits von Total in Neuseeland errichtet. Eine weitere Pilotanlage wurde über längere Zeit in Berrenrath, Deutschland, von Rheinbraun betrieben. Sie wurde gemeinsam von Uhde und Lurgi errichtet.
Methanol (und analog auch Ethanol) kann also in vielfältiger Form im Verkehrswesen eingesetzt werden.
- Methanol kann aus einer Vielzahl unterschiedlicher Primärenergien hergestellt werden wie Erdgas, Kohle, Ölschiefer und Teersande, aber auch aus Biomasse, Holz und kommunalen Abfällen. Die hierfür notwendigen Umwandlungsverfahren sind bekannt und erprobt.
- Als flüssiger Kraftstoff ist Methanol wegen der einfachen Handhabung im Vergleich zu gasförmigen Kraftstoffen besonders für den Verkehrssektor geeignet (Straße, Wasser, Schiene, Luftfahrt mit Einschränkungen).
- In angepassten Motoren (für Reinmethanol M100 bzw. M85) lassen sich im Vergleich zu Benzinmotoren eine bis zu 10% höhere Motorleistung und ein etwa 15% besserer thermischer Wirkungsgrad erzielen, dadurch ein günstigerer energetischer Kraftstoffverbrauch.
- Während sich bei den limitierten Emissionen (HC, CO, NOx) mit der heute bei Ottomotoren üblichen Katalysatortechnik keine Vorteile mehr ergeben, sind bei den nichtlimitierten Emissionen geringe Vorteile zu verzeichnen, beispielsweise keine Aromaten (Benzol, Toluol), niedrigere PAK-Emissionen und geringeres Ozonbildungspotential (siehe auch Sommersmog). Nachteilig ist dagegen die erhöhte Formaldehydemission, wobei das Niveau bei allen hier aufgeführten Emissionskomponenten allerdings wegen des Katalysators sehr niedrig ist. Bei Dieselkonzepten entfallen weitgehend Schwefelemissionen und Rußbildung.
- Nachteilig ist der bis zu etwa 50 % höhere volumetrische Kraftstoffverbrauch wegen des geringeren Heizwertes von Methanol.
- Nachteilig ist insbesondere die Giftigkeit von Methanol, was besondere Vorsichtsmaßnahmen bei der Betankung und bei Arbeiten am Fahrzeug erfordert. Da Methanol biologisch abbaubar ist, ist die Umweltgefährdung bei eventuellen Unfällen jedoch gering.
- Im US-Motorsport: nach schweren Feuerunfällen beim Indianapolis 500 wurde in den 1960er Jahren in davon abgeleiteten amerikanischen Formel-Rennserien (CART, Indy Car) das mit Wasser nicht löschbare Benzin durch Methanol ersetzt, welches durch Wasser verdünnt werden kann. Nachteil dabei wiederum ist, dass brennendes reines Methanol nicht sichtbar ist. So wird nach dem Tankvorgang im Rennen stets Wasser über den Tankstutzen gespritzt, um etwaig ausgelaufenes Methanol wegzuspülen, bevor es sich an heißen Teilen entzündet. Methanol und Alkohol sind besonderes für aufgeladene Motoren geeignet. Dragster mit Kompressor-V8-Motoren der Klassen Top Alcohol bzw. Top Methanol erzielen Leistungen um 3000 PS.
Anmerkung:
Das Umweltbundesamt lehnt den Einsatz von – vor allem aus Erdgas gewonnenem – Methanol als Kraftstoff ab, "da das Erdgas auch ohne die Verluste der Methanolherstellung direkt genutzt werden könnte".[10]
In der Chemie
Methanol ist einer der wichtigsten Ausgangsstoffe für Synthesen in der chemischen Industrie. Es wird vor allem für folgende Produkte bzw. Reaktionen verwendet (nach der eingesetzten Menge geordnet):
- Herstellung von MTBE als Zusatz für Ottokraftstoffe aus Methanol und Isobuten:
- Oxidation mit Sauerstoff am Silber-Katalysator zu Formaldehyd:
- Essigsäure-Herstellung aus Methanol und Kohlenstoffmonoxid,
- Umsetzung mit Carbonsäuren zu Methylestern wie z. B. Essigsäuremethylester,
- Umesterung von Fetten zu Methylestern von Fettsäuren wie z. B. Rapsölmethylester,
- Herstellung von Chlormethanen,
- Herstellung von Methylmethacrylat, dem Monomer des Polymethylmethacrylats,
- Herstellung von Methylethern,
- Herstellung von Methylaminen; Methylamine sind ein wichtiges Vorprodukt für Farbstoffe, Medikamente und Pflanzenschutzmittel,
- Einsatz im Kunststoffrecycling (z. B. Methanolyse von PET).
Sonstige Anwendungen
Methanol findet als Lösungs- und Frostschutzmittel Einsatz.
In Wärmerohren im mittleren Temperaturbereich bis 500 K dient Methanol als Übertrager-Fluid.
Ebenso findet es Anwendung bei der Sensorreinigung von digitalen Spiegelreflexkameras, da es keine Schlieren hinterlässt und rückstandslos verdunstet.
Nachweis
Organoleptisch: Methanol hat einen unverwechselbaren, süßlichen Geruch, nicht etwa einen alkoholischen wie Ethanol (Weingeist).
Wird Methanol mit Borax vermischt und angezündet, verbrennt das dabei entstehende Trimethylborat mit intensiv grüner Flamme. Diese Reaktion funktioniert mit ähnlichem Ergebnis, aber weniger intensiver Grünfärbung auch mit Ethanol, allerdings nur mit einem Zusatz von konzentrierter Schwefelsäure. Deswegen können Ethanol und Methanol mit dieser sogenannten Boraxprobe unterschieden werden.
Giftigkeit
Methanol selbst ist nur von geringer Toxizität, wohl giftig sind aber seine Metabolite, so der durch die Alkoholdehydrogenase (ADH) gebildete Formaldehyd und die daraus entstehende Ameisensäure. Insbesondere letztere führt nach einer häufig symptomlosen Latenzzeit von 6 bis 30 Stunden nach Methanolaufnahme zur Ausbildung einer metabolischen Azidose. Ameisensäure wird vom menschlichen Stoffwechsel nur sehr langsam abgebaut und sammelt sich so während des vergleichsweise zügigen Abbaus des Methanols im Körper an.
Dosen von 0,1 g Methanol pro kg Körpergewicht sind gefährlich, über 1 g pro kg Körpergewicht lebensbedrohlich. Die Vergiftungssymptome einer Methanolintoxikation verlaufen in drei Phasen. Direkt nach Aufnahme von Methanol zeigt sich wie beim Ethanol ein narkotisches Stadium, die berauschende Wirkung ist jedoch geringer als bei Ethanol. Nach der häufig asymptomatischen Latenzphase treten Kopfschmerzen, Schwächegefühl, Übelkeit, Erbrechen, Schwindel, beschleunigte Atmung auf – die Folgen der sich ausbildenden metabolischen Azidose. Charakteristisch ist die Schädigung von Nerven, insbesondere am Auge. Netzhautödeme bedingen ein nur noch verschwommenes Sehen und können zur irreversiblen Erblindung führen. Der Tod kann als Folge einer Atemlähmung eintreten.
Die Behandlung einer Methanolintoxikation erfolgt über eine Unterbindung des Methanolmetabolismus, z. B. durch Ethanolgaben (0,7 g Ethanol pro kg Körpergewicht), wodurch der Methanolabbau kompetitiv gehemmt wird, bzw. durch Gaben des ADH-Inhibitors 4-Methylpyrazol (Fomepizol). Der Ameisensäureabbau kann durch Folsäuregaben gefördert werden. Einer Azidose kann durch Darreichung von Natriumhydrogencarbonat begegnet werden; ggf. wird eine Hämodialyse notwendig. Die Behandlung ist bis zum Absinken des Blutmethanolgehaltes unter einen bestimmten Grenzwert notwendig.
Methanol entsteht regelmäßig als Nebenprodukt bei der alkoholischen Gärung und reichert sich in Destillaten, z. B. bei der Herstellung von Spirituosen, an. Daher wird bei der Destillation die Methanolfraktion abgetrennt. Um bei der Destillation das Methanol möglichst vollständig zu entfernen, sind große Sorgfalt und Erfahrung sowie ein strenges Temperaturregime vonnöten. Minderwertige Spirituosen können beträchtliche Mengen Methanol enthalten, welche bei übermäßigem Genuss bedenklich sind.
In der Raumluft konnten Arbeiter 20 bis 25 ppm Methanol ohne gesundheitliche Folgewirkungen auch noch nach zwei Jahren vertragen. Methanolkonzentrationen von über 200 ppm führen nach längerer Einatmung zu Kopfschmerzen. Konzentrationen von 500 bis 1100 ppm wurden von freiwilligen Versuchspersonen nur drei bis vier Stunden ertragen.
Methanol wird auch über die Haut sehr gut resorbiert.
Siehe auch
Literatur und Quellen
- H. Menrad, A. König: Alkoholkraftstoffe. Springer, Wien New York 1982, ISBN 3-211-81696-8.
- Der Bundesminister für Forschung und Technologie (Hrsg.): Entwicklungslinien in Kraftfahrzeugtechnik und Straßenverkehr. Forschungsbilanzen 1977 bis 1985, TÜV Rheinland GmbH, Köln.
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p q Eintrag zu Methanol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 5. Januar 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 67-56-1 im European chemical Substances Information System ESIS
- ↑ http://www.methanex.com/ourcompany/index.html
- ↑ http://www.ttmethanol.com/index.htm
- ↑ Methanol Institute : View a PDF
- ↑ http://www.lurgi.com/website/fileadmin/user_upload/pdfs/17-Methanol-DE.pdf
- ↑ Methanol statt Wasserstoff, Technology Review, Juli 2006
- ↑ Publikationen des Deutschen Patent- und Markenamtes (DPMA)
- ↑ JAWA-Zylinderköpfe
- ↑ Bewertung alternativer Treibstoffe und Antriebe
Weblinks
Wikimedia Foundation.