- Grignardsche Verbindungen
-
Eine Grignard-Verbindung ist ein nach Victor Grignard benanntes metallorganisches Reagenz. Dieser bekam für die Entdeckung der Grignard-Verbindungen 1912 den Nobelpreis für Chemie. Grignard-Verbindungen entstehen, wenn ein Alkylhalogenid (z. B. Brommethan BrCH3) oder ein Arylhalogenid (z. B. Chlorbenzen C6H5Cl) in Anwesenheit von trockenem Diethylether oder Tetrahydrofuran mit metallischem Magnesium reagiert. Die Grignard-Reaktion, die mit Hilfe dieser Reagenzien durchgeführt wird, ist eine wichtige Reaktion in der organischen Chemie.
Inhaltsverzeichnis
Bildung
Das Magnesium-Atom insertiert in die Kohlenstoff-Halogen-Bindung. Zwei freie Elektronenpaare von Ethermolekülen koordinieren an das Magnesium und stellen das zur Stabilität notwendige Elektronenoktett (siehe: Oktettregel) her.
Der erste Schritt der Synthese einer Magnesium-organischen Verbindung ist analog einer Sandmeyer-Reaktion zu beschreiben: Das Magnesium transferiert ein Elektron in das LUMO der organischen Verbindung unter Bildung eines Radikal-Anions. Hierin ist die negative Ladung möglicherweise direkt am Halogenid lokalisiert. Der zweite Schritt ist eine oxidative Addition: Das einfach positiv geladene Magnesium-Ion geht mit dem organischen Rest eine Bindung ein, während das Halogenid-Anion abgespaltet wird. Je nach Lösungsmittel existiert dabei noch eine polare Bindung zum Halogenid.
Schlenk-Gleichgewicht
Das Schlenk-Gleichgewicht (benannt nach Wilhelm Schlenk) beschreibt die molekulare Zusammensetzung bzw. dessen Verteilung in Abhängigkeit des Lösungsmittel. In Diethylether liegt das Gleichgewicht praktisch vollständig auf der Seite von RMgX, in 1,4-Dioxan dagegen praktisch vollständig auf der Seite von R2Mg und in Tetrahydrofuran ziemlich in der Mitte zwischen beiden Extremfällen.
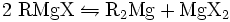
Eigenschaften
Die Grignard-Verbindung hat die allgemeine Formel RMgX (wobei X hier für eines der Halogene Chlor, Brom oder Iod steht). Alkyl- bzw. Arylfluoride reagieren normalerweise nicht zu einer Grignard-Verbindung.
In der Grignard-Verbindung trägt das dem Magnesium benachbarte Kohlenstoffatom eine negative Partialladung, es wird sozusagen „umgepolt“.
Grignard-Reagenzien reagieren sehr heftig mit Wasser, -SH oder -NH-Gruppen, weshalb trockener Ether für eine Grignard-Reaktion verwendet werden muss. Ähnlich, wenngleich teilweise heftiger, reagieren metallorganische Lithium-Verbindungen.
Verwendung der Grignard-Verbindungen
Die Bedeutung der Grignard-Verbindungen liegt darin, dass sie sehr gute Nucleophile sind. Sie reagieren unter der neuen Bildung einer Kohlenstoff-Kohlenstoff-Bindung mit Elektrophilen wie beispielsweise mit Ketonen, Aldehyden, Estern und Nitrilen. Grignard-Verbindungen reagieren mit Kohlenstoffdioxid zu Magnesium-Salzen von Carbonsäuren. Analog reagieren Grignard-Verbindungen mit Schwefelkohlenstoff. Die Hydrolyse der Umsetzungsprodukte liefert Carbonsäuren, R-CO2H, bzw. Dithiocarbonsäuren, R-CS2H. Bei der Reaktion von Grignard-Verbindungen mir elementarem Selen bilden sich durch eine Insertionsreaktion Substanzen des Typs RSeMgX; deren Hydrolyse liefert unter Sauerstoffausschluss Selenole, in Gegenwart von Luftsauerstoff entstehen Diselenide.
Technische Bedeutung
Früher hatte eine elektrochemische Variante der Grignard-Reaktion, also die Reaktionen von Grignard-Verbindungen eine Bedeutung bei der Herstellung von Tetraethylblei, einer dem Benzin zur Erhöhung der Klopffestigkeit zugesetzten organischen Bleiverbindung. In der Synthese von Arzneistoffen wird die Grignard-Reaktion häufig angewandt.
Wikimedia Foundation.
