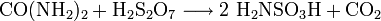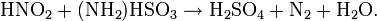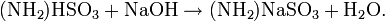- H3SO3N
-
Strukturformel 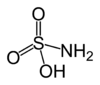
Allgemeines Name Amidosulfonsäure Andere Namen - Amidoschwefelsäure
- Sulfamidsäure
- Sulfamsäure
- Sulfaminsäure
Summenformel H3SO3N CAS-Nummer 5329-14-6 Kurzbeschreibung Farblose bis weißlich-gelbe Kristalle Eigenschaften Molare Masse 97,09 g·mol−1 Aggregatzustand fest
Dichte 2.13 g·cm−3[1]
Schmelzpunkt 205 °C (Zersetzung)[1]
Dampfdruck 0,0078 hPa[1] (20 °C)
Löslichkeit 213 g/l in Wasser bei 20 °C[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Reizend (Xi) R- und S-Sätze R: 36/38-52/53 S: (2)-26-28-61 LD50 >2000 mg/kg[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Amidosulfonsäure ist eine farblose kristalline Substanz, die als Säureamid der Schwefelsäure aufgefasst werden kann. Ihre Salze werden Amidosulfonate oder Sulfamate genannt.
Inhaltsverzeichnis
Herstellung
Die Herstellung von Amidosulfonsäure erfolgt mit Harnstoff, Schwefelsäure und Dischwefelsäure:[3]
Eigenschaften
Amidosulfonsäure bildet farblose bis weißlich gelbe Kristalle, die bei 205 °C unter beginnender Zersetzung und heftiger Rauchentwicklung schmelzen und sich gut in Wasser lösen. Die Lösung reagiert sauer. Aufgrund der Säureeigenschaften wirkt sie bei Direktkontakt reizend und ätzend auf Augen und Haut.
Verwendung
Amidosulfonsäure ist (meist neben Phosphorsäure) ein Bestandteil von Entkalkern und Sanitärreinigern, im Labor wird sie als Urtitersubstanz und zum Zerstören von Nitrit verwendet:
In der Galvanotechnik verwendet man Amidosulfonsäure zum Einstellen des pH-Wertes von Nickelsulfamatbädern auf pH 3,9 bis 4,2. Auch wird eine Lösung aus Amidosulfonsäure mit Natriumlaurylsulfat bei 35 bis 40 °C zum Aktivieren einer Nickelschicht benutzt.
Bestimmung
Der Gehalt einer wässrigen Amidosulfonsäurelösung kann mittels Titrationanalyse bestimmt werden. Die Reaktionsgleichung dieser Säure-Base-Titration lautet wie folgt:
Quellen
- ↑ a b c d e Sicherheitsdatenblatt (Merck)
- ↑ Eintrag zu CAS-Nr. 5329-14-6 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 508.
Wikimedia Foundation.