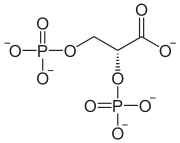
- 2,3-DPG-Zyklus
-
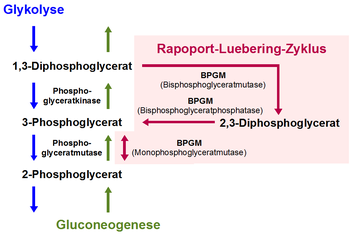
Der Rapoport-Luebering-Zyklus, auch als Rapoport-Luebering-Shunt, Rapoport-Luebering-Shuttle, Phosphoglyceratzyklus oder 2,3-DPG-Zyklus bezeichnet, ist in der Biochemie ein vor allem in roten Blutkörperchen (Erythrozyten) von Säugetieren ablaufender Stoffwechselweg, also eine Abfolge von enzymatisch gesteuerten chemischen Reaktionen. Es handelt sich um einen Nebenweg der Glykolyse, die für die Energiegewinnung und den Kohlenhydratstoffwechsel fast aller Lebewesen von zentraler Bedeutung ist. Der Rapoport-Luebering-Zyklus gehört somit zu den biochemischen Prozessen zum Abbau von Glukose im tierischen Organismus. Seine Hauptreaktion ist die durch das Enzym Bisphosphoglyceratmutase gesteuerte Bildung des Zwischenprodukts 2,3-Diphosphoglycerat (2,3-DPG) aus dem in der Glykolyse entstehenden 1,3-Diphosphoglycerat.
2,3-DPG fungiert als wichtiger biochemischer Effektor für die Regulation der Bindungfähigkeit (Affinität) des Blutfarbstoffs Hämoglobin für das Atemgas Sauerstoff, insbesondere für deren längerfristige Anpassung an Sauerstoffmangelzustände, und ist damit für die Freisetzung des Sauerstoffs aus den Erythrozyten ins Gewebe von Bedeutung. Darüber hinaus ist es an der enzymatischen Steuerung der Glykolyse beteiligt und ein Energie- und Phosphatspeicher in den Eryothrozyten. Durch die in den 1940er Jahren erfolgte Entdeckung des Rapoport-Luebering-Zyklus sowie der Bedeutung des 2,3-DPG für den Energiehaushalt der roten Blutkörperchen durch den Biochemiker Samuel Mitja Rapoport und seine Assistentin Janet Luebering konnte die Haltbarkeit von Blutkonserven erheblich gesteigert werden.
Inhaltsverzeichnis
Biochemische Aspekte
Ablauf
Beim Rapoport-Luebering-Zyklus handelt es sich um einen in den roten Blutkörperchen der Säugetiere einschließlich des Menschen stattfindenden Nebenweg der anaeroben Glykolyse. Er führt ausgehend vom 1,3-Diphosphoglycerat (1,3-DPG) aus der Glykolyse zur Bildung von 2,3-Diphosphoglycerat (2,3-DPG); aus diesem entstehen die zum Reaktionsablauf der Glykolyse gehörenden Phosphoglycerinsäure-Verbindungen 3-Phosphoglycerat (3-PG) und, durch dessen Isomerisierung, 2-Phosphoglycerat (2-PG).[1]
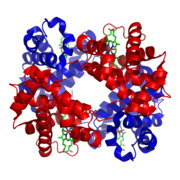
Das für diese Reaktionen verantwortliche Enzym Bisphosphoglyceratmutase (BPGM) ist in seinem Vorkommen im Wesentlichen auf Erythrozyten und erythropoetisches Gewebe beschränkt und weist als trifunktionales Enzym drei verschiedene Aktivitäten auf.[2][3] Sie fungiert in Abhängigkeit vom pH-Wert entweder als Synthase (2,3-DPG-Synthase, synonym Bisphosphoglyceratmutase; EC-Nummer 5.4.2.4) für die Umwandlung des 1,3-DPG zu 2,3-DPG oder als Phosphatase (2,3-Bisphosphoglyceratphosphatase; EC-Nummer 3.1.3.13) für die Umsetzung des 2,3-DPG zu 3-PG. Darüber hinaus katalysiert sie als Mutase (Monophosphoglyceratmutase; EC-Nummer 5.4.2.1) die Gleichgewichtsreaktion zwischen 3-PG und 2-PG.[3]
Hauptaktivität der BPGM ist dabei die Synthasereaktion vom 1,3-DPG zu 2,3-DPG, die irreversibel verläuft. Über die Phosphoglyceratmutase ist die Umsetzung von 3-PG zu 2-PG auch eine in anderen Zellen ablaufende Teilreaktion der Glykolyse. Für die Phosphoglyceratmutase, die der BPGM hinsichtlich ihrer Molekülmasse, ihrer Untereinheitenstruktur und ihrer Aminosäuresequenz ähnelt, wurden darüber hinaus auch geringe Aktivitäten als 2,3-DPG-Synthase und -phosphatase gefunden.[4] Sie fungiert somit wahrscheinlich ähnlich der BPGM als trifunktionales Enzym, jedoch mit einem anderen Verhältnis der drei Enzymaktivitäten zueinander. Dies gilt, neben der Expression der BPGM in einigen nicht-erythropoetischen Geweben wie in der Plazenta und in der Leber, als mögliche Erklärung für das Auftreten geringer Mengen von 2,3-DPG in nicht-erythroiden Zellen.[5] Die Rückreaktionen vom 2-PG über 3-PG zum 1,3-DPG und damit der Teilprozesse der Glykolyse, die parallel zum Rapoport-Luebering-Zyklus ablaufen, finden im Rahmen der Gluconeogenese statt.
Bilanz und Regulation
Der erste Schritt des Rapoport-Luebering-Zyklus, die Umlagerung vom 1,3-DPG zum 2,3-DPG, ist eine Isomerisierung mit neutraler stofflicher Bilanz. Die Bisphosphoglyceratmutase als Enzym dieser Reaktion benötigt allerdings das Vorhandensein von Magnesium-Ionen.[6] Die hydrolytische Spaltung vom 2,3-DPG zum 3-PG im zweiten Schritt verläuft unter Verbrauch eines Wassermoleküls und Freisetzung eines anorganischen Phosphats. Im Rapoport-Luebering-Zyklus entsteht – im Gegensatz zur Umsetzung von 1,3-DPG zu 3-PG durch die Phosphoglyceratkinase in der Glykolyse – kein Adenosintriphosphat (ATP). Die Energieausbeute ist damit beim Nebenweg über das 2,3-DPG geringer als beim direkten Weg in der Glykolyse.
3-PG und 2,3-DPG selbst hemmen den Rapoport-Luebering-Zyklus, der damit autoregulatorisch verläuft.[7] 2,3-DPG hemmt außerdem einige in der Reaktionsfolge der Glykolyse vor dem Rapoport-Luebering-Zyklus liegende Enzyme wie beispielsweise die Hexokinase und die Phosphofructokinase.[1] Darüber hinaus fungiert es als Kofaktor der Phosphoglyceratmutase in der Glykolyse.[8] Ein Anstieg der 1,3-DPG-Menge stimuliert die Entstehung von 2,3-DPG. Alle Prozesse der Glykolyse, die über Aktivierung oder Hemmung von Enzymen zu einer Erhöhung der 1,3-DPG-Konzentration führen, beschleunigen damit die 2,3-DPG-Bildung.[7]
Auch durch einen Anstieg des pH-Wertes entsteht vermehrt 2,3-DPG, da der optimale pH-Wert für die Synthase-Aktivität der DPGM bei etwa 7,2 liegt, während die Phosphatase-Aktivität ihr Optimum im sauren Bereich hat und dann gegenüber der 2,3-DPG-Bildung überwiegt. Die Hormone Thyroxin, Somatotropin, Testosteron und Erythropoietin stimulieren die Bildung des 2,3-DPG.[9] Durch Chlorid, Phosphat und vor allem durch den physiologischen Phosphataseaktivator 2-Phosphoglycolat kommt es hingegen zu einer verstärkten Spaltung von 2,3-DPG zu 3-PG durch die Phosphatase-Funktion der BPGM.[3]
Bedeutung
Physiologische Funktion
Da die roten Blutkörperchen der Säugetiere im Gegensatz zu den meisten anderen Körperzellen nicht über einen Zellkern oder über Mitochondrien verfügen, besitzen sie einen spezialisierten Kohlenhydrat- und Energiestoffwechsel. Die Glykolyse ist in den Erythrozyten neben dem Pentosephosphatweg die einzige Möglichkeit zur Energiegewinnung.[10] Etwa 20 Prozent des in den Erythrozyten in der Glykolyse entstehenden 1,3-DPG wird dabei über den Rapoport-Luebering-Zyklus umgesetzt, der Anteil des gebildeten 2,3-DPG beträgt etwa 50 Prozent aller Intermediate der Glykolyse in den Erythrozyten.[1] Unter physiologischen Bedingungen liegt 2,3-DPG in den roten Blutkörperchen etwa in der gleichen molaren Konzentration wie der Blutfarbstoff Hämoglobin und rund dem Vierfachen der ATP-Konzentration vor.[7] Die Menge an 2,3-DPG wird bestimmt durch das Verhältnis zwischen der Synthase- und der Phosphatase-Aktivität der BPGM.
Das im Rapoport-Luebering-Zyklus entstehende 2,3-DPG fungiert vor allem als allosterischer Inhibitor des Hämoglobins, indem es dessen nicht mit Sauerstoff beladene Deoxy-Form stabilisiert, und reguliert damit umgekehrt proportional zu seiner Konzentration in den roten Blutkörperchen die Bindungsfähigkeit (Affinität) des Hämoglobins für Sauerstoff.[7] Ein Anstieg der 2,3-DPG-Konzentration verschiebt die Sauerstoffbindungskurve des Hämoglobins nach rechts, wodurch der gebundene Sauerstoff leichter abgegeben wird, ein Absinken der 2,3-DPG-Konzentration führt umgekehrt zu einer Linksverschiebung der Sauerstoffbindungskurve und damit einer stärkeren Bindung des Sauerstoffs an das Hämoglobin. Das Ausmaß der Wirkung von 2,3-DPG auf Hämoglobin unterscheidet sich jedoch zwischen verschiedenen Tierarten.[9][11] Die Hämoglobine von Menschen, Pferden, Hunden, Schweinen, Kaninchen, Meerschweinchen, Mäusen und Ratten, deren Erythrozyten eine hohe 2,3-DPG-Konzentration aufweisen, reagieren dementsprechend stark. Demgegenüber ist die Wirkung des 2,3-DPG auf das Hämoglobin ebenso wie der 2,3-DPG-Gehalt in den roten Blutkörperchen in Schafen, Ziegen, Rindern und Katzen geringer. In Vögeln fungiert 2,3-DPG nur während der Embryonalentwicklung als Regulator der Sauerstoffaffinität des Hämoglobins. Wenige Tage nach dem Schlüpfen aus dem Ei wird es dann vollständig abgebaut, die Funktion des 2,3-DPG übernehmen im weiteren Leben Inositolphosphate wie Inositolhexaphosphat (IHP).[12] In Fischen wurde 2,3-DPG nur in wenigen Arten gefunden, die dominierenden Organophosphate in Fischerythrozyten sind ATP und Guanosintriphosphat (GTP).[13] In den Erythrozyten von Reptilien kommen als Organophosphate vorwiegend ATP, IHP und Myo-Inositol-5-Phosphat (IP5) vor. Als Grund für diese Unterschiede zwischen Säugetieren und anderen Wirbeltieren gilt der besondere Energiestoffwechsel der Erythrozyten der Säugetiere. In den kernhaltigen Erythrozyten anderer Wirbeltiere ist die Atmungskette der primäre energieliefernde Stoffwechselweg und nicht, wie in den roten Blutkörperchen der Säugetiere, die Glykolyse.[13]
Weitere Faktoren, die zu einem Anstieg der Sauerstoffaffinität des Hämoglobins führen und dabei zum Teil auch den 2,3-DPG-Spiegel beeinflussen, sind eine Abnahme der Temperatur, ein Anstieg des pH-Wertes und ein Absinken der Kohlendioxidkonzentration. Die kombinierte Wirkung des pH-Werts und des Kohlendioxidpartialdrucks auf die Bindungsfähigkeit des Hämoglobins für Sauerstoff wird auch als Bohr-Effekt bezeichnet und ist die physikochemische Grundlage der Regulation des Gasaustausches in der Lunge sowie der Versorgung stoffwechselaktiver Gewebe mit Sauerstoff. Kohlenmonoxid verringert hingegen die Bindungskapazität des Hämoglobins für Sauerstoff, da es mit dem Sauerstoff um die gleiche Bindungsstelle im Hämoglobinmolekül konkurriert. Ein Anstieg der 2,3-DPG-Menge verbessert die Sauerstoffabgabe in der Körperperipherie und damit die Sauerstoffversorgung in den Geweben, insbesondere unter ungünstigen Bedingungen wie Zuständen, die mit einem Sauerstoffmangel einhergehen. So führt beispielsweise ein Aufenthalt in höheren Lagen zu einer Steigerung der 2,3-DPG-Konzentration, die etwa zwei Tage nach Rückkehr auf die Ausgangshöhe wieder Normalwerte erreicht.[7] Auch körperliche Kurz- oder Langzeitbelastung sowie Ausdauertraining haben in unterschiedlichem Ausmaß Auswirkungen auf die Konzentration des 2,3-DPG.[11] Neben dieser Funktion als Kompensationsmechanismus spielt der Rapoport-Luebering-Zyklus wahrscheinlich auch eine Rolle in der Regulation der Stoff- und Energiebilanz der Glykolyse.[9][11] So ermöglicht er eine verstärkte Bildung des Koenzyms Nicotinamidadenindinukleotid (NADH) in der Glykolyse ohne eine nachfolgende Zunahme der ATP-Konzentration sowie den Ablauf der Glykolyse auch bei geringem ATP-Bedarf. Darüber hinaus stellt 2,3-DPG einen erythrozytären Energie- sowie Phosphatspeicher dar.
Medizinische Relevanz
Enzymdefekte in denjenigen Reaktionen der Glykolyse, die nach der Bildung des 2,3-DPG ablaufen, bewirken durch einen Anstieg von dessen Konzentration eine Abnahme der Sauerstoffaffinität von Hämoglobin und damit eine gesteigerte Freisetzung von Sauerstoff im Gewebe.[1] Umgekehrt führen Defekte in den Reaktionen der Glykolyse vor dem Rapoport-Luebering-Zyklus zu einer Abnahme der 2,3-DPG-Konzentration und damit zu einer Verminderung der Sauerstoffabgabe im Gewebe.
Eine gezielte Regulierung der Bisphosphoglyceratmutase zur Beeinflussung der 2,3-BPG-Konzentration in den Erythrozyten wäre beispielsweise therapeutisch von Interesse zur Behandlung von Ischämien und der Sichelzellenanämie.[3][14] Für Diabetes-Patienten wurde eine Verringerung der BPGM-Aktivität durch Glykation beschrieben.[2] Eine angeborene Defizienz der BPGM ist bisher erst in wenigen Fällen dokumentiert worden.[15] Die betroffenen Personen waren abgesehen von einer sekundären Erythrozytose (vermehrte Bildung roter Blutkörperchen) weitestgehend beschwerdefrei. Eine labormedizinische Bestimmung des 2,3-DPG in Erythrozyten und im Serum ist möglich, aufgrund der geringen diagnostischen Aussagekraft jedoch nicht gebräuchlich und nur für spezielle Fragestellungen von Interesse.
Das 2,3-DPG in den Erythrozyten hat ebenso wie das ATP Einfluss auf die Lagerungsfähigkeit von Blutkonserven. Aufgrund des Anstiegs der Laktatkonzentration mit fortschreitender Lagerungsdauer verschiebt sich der pH-Wert des entnommenen Bluts in den sauren Bereich, wodurch das 2,3-DPG verstärkt abgebaut und seine Neubildung gehemmt wird. Durch die Zugabe von Zusätzen wie Dextrose und Adenin, wie sie beispielsweise in den gegenwärtig verwendeten CPDA- beziehungsweise CPD/SAGM-Blutbeuteln enthalten sind, lässt sich die Abnahme des 2,3-DPG-Gehaltes verzögern und damit die Haltbarkeit und Funktion von gelagertem Blut verbessern.[16]
Entdeckungsgeschichte
2,3-DPG, das Reaktionsprodukt des Rapoport-Luebering-Zyklus, wurde 1925 erstmals beschrieben und isoliert.[17] Die für die 2,3-DPG-Bildung wesentlichen Reaktionen wurden in den 1940er Jahre von Samuel Mitja Rapoport und seiner damaligen technischen Assistentin Janet Luebering entdeckt und Anfang der 1950er Jahre in mehreren gemeinsamen Veröffentlichungen beschrieben.[18][19] Die Erforschung dieses Stoffwechselweges führte zur Entwicklung des Citrat- und Dextrose-haltigen ACD-Mediums, mit dem die Haltbarkeit von Blutkonserven von einer auf rund drei Wochen gesteigert werden konnte. Aufgrund der Bedeutung dieser Entdeckung für die Militärmedizin während des Zweiten Weltkrieges wurde Samuel Mitja Rapoport vom US-Präsidenten Harry S. Truman mit dem „President’s Certificate of Merit“ geehrt.[20] Samuel Mitja Rapoport, der 1937 ein einjähriges Stipendium am Kinderkrankenhaus der University of Cincinnati erhielt und nach der deutschen Annexion Österreichs wegen seiner jüdischen Abstammung nicht nach Europa zurückkehrte, ging aufgrund seiner politischen Überzeugungen 1952 in die Deutsche Demokratische Republik (DDR), in der er zu einem der führenden Biochemiker des Landes wurde. Er führte hier seine Forschung zum Stoffwechsel der roten Blutkörperchen weiter und veröffentlichte unter anderem in den 1970er Jahren zusammen mit seiner als Kinderärztin tätigen Frau Ingeborg Rapoport und seinem Sohn Tom Rapoport, der 1995 an die Harvard University wechselte, Beiträge zur pH-Abhängigkeit der 2,3-DPG-Bildung und zur Regulation der Glykolyse in den Erythrozyten.
Die Eigenschaften der Bisphosphoglyceratmutase als dem zentralen Enzym des Rapoport-Luebering-Zyklus und ihre trifunktionale Aktivität wurden in den 1960er und 1970er Jahren näher charakterisiert.[4][21] 1967 erfolgte die Aufklärung der Wirkung von 2,3-DPG auf Hämoglobin,[22] 1978 wurde das angeborene Auftreten einer vollständigen BPGM-Defizienz in einem Patienten beschrieben.[23] Zehn Jahre später erfolgte die Isolierung und Charakterisierung des auf dem menschlichen Chromosom 7 liegenden Gens für das Enzym.[5] Die molekularen Grundlagen der Funktion der BPGM wurden in den 1990er Jahren näher untersucht,[14][24] 2004 wurde die Kristallstruktur des Enzymmoleküls aufgeklärt.[3] Vier Jahre später wurde beschrieben, dass das in verschiedenen Geweben vorkommende Enzym Multiple Inositol-Polyphosphat-Phosphatase (MIPP) ebenfalls eine Aktivität als 2,3-DPG-Phosphatase aufweist.[25] Diese Entdeckung ist für die Regulation der Abgabe von Sauerstoff aus dem Hämoglobin und damit für die physiologische Rolle des Rapoport-Luebering-Zyklus von Bedeutung.
Literatur
- ↑ a b c d R. van Wijk, W.W. van Solinge: The energy-less red blood cell is lost: erythrocyte enzyme abnormalities of glycolysis. In: Blood. 106(13)/2005. American Society of Hematology, S. 4034–4042, ISSN 0006-4971
- ↑ a b T. Fujita et al.: Human Erythrocyte Bisphosphoglycerate Mutase: Inactivation by Glycation In Vivo and In Vitro. In: Journal of Biochemistry. 124(6)/1998. Japanese Biochemical Society, S. 1237–1244, ISSN 0021-924X
- ↑ a b c d e Y. Wang et al.: Crystal Structure of Human Bisphosphoglycerate Mutase. In: Journal of Biological Chemistry. 279/2004. The American Society for Biochemistry and Molecular Biology, S. 39132–39138, ISSN 0021-9258
- ↑ a b R. Sasaki, K. Ikura, E. Sugimoto, H. Chiba: Purification of bisphosphoglycerate mutase, bisphosphoglycerate phosphatase and phosphoglycerate mutase from human erythrocytes: three enzyme activities in one protein. In: European Journal of Biochemistry. 50(3)/1975. Federation of European Biochemical Societies, S. 581–593, ISSN 1742-464X
- ↑ a b V. Joulin et al.: Isolation and characterization of the human 2,3-bisphosphoglycerate mutase gene. In: Journal of Biological Chemistry. 263/1988. The American Society for Biochemistry and Molecular Biology, S. 15785–15790, ISSN 0021-9258
- ↑ Gerhard Michal: Biochemical Pathways: Biochemie-Atlas. Spektrum Akademischer Verlag, Heidelberg 1999, ISBN 3-86-025239-9, S. 27/28
- ↑ a b c d e Georg Löffler, Petro E. Petrides: Biochemie und Pathobiochemie. 7. Auflage. Springer-Verlag, Berlin und Heidelberg 1998, ISBN 3-540-42295-1, S. 986 und 994/995
- ↑ H. Chiba, R. Sasaki: Functions of 2,3-bisphosphoglycerate and its metabolism. In: Current Topics in Cellular Regulation. 14/1978. Academic Press, S. 75–116ISSN 0070-2137
- ↑ a b c Larry Rex Engelking: Review of Veterinary Physiology. Teton NewMedia, Jackson WY 2002, ISBN 1-89-344169-5, S. 130
- ↑ Gerhard Thews, Ernst Mutschler, Peter Vaupel: Anatomie, Physiologie und Pathophysiologie des Menschen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1999, ISBN 3-8047-1616-4, S. 117
- ↑ a b c Nemi C. Jain: Essentials of Veterinary Hematology. Lea & Febiger, Philadelphia 1993, ISBN 0-81-211437-X, S. 145
- ↑ R.E. Isaacks, L.L. Lai, P.H. Goldman, C.Y. Kim: Studies on avian erythrocyte metabolism. XVI. Accumulation of 2,3-bisphosphoglycerate with shifts in oxygen affinity of chicken erythrocytes. In: Archives of Biochemistry and Biophysics. 257(1)/1987. Academic Press, S. 177–185, ISSN 0003-9861
- ↑ a b Organic Phosphate Effects on Oxygen Affinity. In: Stephen C. Wood, Claude Lenfant: Evolution of Respiratory Processes. A Comparative Approach. Informa Health Care, 1979, ISBN 0-82-476793-4, S. 212–214
- ↑ a b P. Ravel, C.T. Craescu, N. Arous, J. Rosa, M.C. Gare: Critical Role of Human Bisphosphoglycerate Mutase Cys22 in the Phosphatase Activator-binding Site. In: Journal of Biological Chemistry. 272/1997. The American Society for Biochemistry and Molecular Biology, S. 14045–14050, ISSN 0021-9258
- ↑ Online Mendelian Inheritance in Man: Eintrag 222800 (siehe Weblinks)
- ↑ J.R. Hess, T.G. Greenwalt: Storage of Red Blood Cells: New Approaches. In: Transfusion Medicine Reviews. 16(49/2002. Elsevier, S. 283–295, ISSN 0887-7963
- ↑ R. Juel: 2,3-Diphosphoglycerate: its role in health and disease. In: CRC Critical Reviews in Clinical Laboratory Sciences. 10(2)/1979. CRC Press, S. 113–146, ISSN 0590-8191
- ↑ S. Rapoport, J. Luebering: The formation of 2,3-diphosphoglycerate in rabbit erythrocytes: The existence of a diphosphoglycerate mutase. In: Journal of Biological Chemistry. 183/1950. S. 507–516
- ↑ S. Rapoport, J. Luebering: Glycerate-2,3-diphosphatase. In: Journal of Biological Chemistry. 189/1951. S. 683–694
- ↑ A. Tuffs: Samuel Mitja Rapoport. Nachruf in: British Medical Journal. 329/2004. BMJ Group, S. 353, ISSN 0959-8138
- ↑ Z.B. Rose: The Purification and Properties of Diphosphoglycerate Mutase from Human Erythrocytes. In: Journal of Biological Chemistry. 243(18)/1968. The American Society for Biochemistry and Molecular Biology, S. 4810–4820, ISSN 0021-9258
- ↑ Reinhold Benesch, Ruth Benesch: The effect of organic phosphates from the human erythrocyte on the allosteric properties of hemoglobin. In: Biochemical and Biophysical Research Communications. 26(2)/1967. Academic Press, S. 162–167, ISSN 0006-291X
- ↑ R. Rosa, M.-O. Prthu, Y. Beuzard, J. Rosa: The first case of a complete deficiency of diphosphoglycerate mutase in human erythrocytes. In: Journal of Clinical Investigation. 62/1978. American Society for Clinical Investigation, S. 907–915, ISSN 0021-9738
- ↑ M.C. Garel, V. Lemarchandel, M.C. Calvin, N. Arous, C.T. Craescu, M.O. Prehu, J. Rosa, R. Rosa: Amino acid residues involved in the catalytic site of human erythrocyte bisphosphoglycerate mutase. Functional consequences of substitutions of His10, His187 and Arg89. In: European Journal of Biochemistry. 213(1)/1993. Federation of European Biochemical Societies, S. 493–500, ISSN 1742-464X
- ↑ J. Cho, J.S. King, X. Qian, A.J. Harwood, S.B. Shears: Dephosphorylation of 2,3-bisphosphoglycerate by MIPP expands the regulatory capacity of the Rapoport-Luebering glycolytic shunt. In: Proceedings of the National Academy of Sciences. 105(16)/2008. United States National Academy of Sciences, S. 5998–6003, ISSN 0027-8424
Weblinks
- UniProt: Bisphosphoglycerate mutase - Homo sapiens (Human) UniProt-Informationen zur Bisphosphoglyceratmutase (englisch)
- OMIM: Diphosphoglycerate Mutase Deficiency of Erythrocyte OMIM-Eintrag zur BPGM-Defizienz (englisch)
Wikimedia Foundation.


_507-516_jpg.jpg)