- Hessscher Satz
-
Der Hess'sche Wärmesatz (auch Satz von Hess) dient der Berechnung von Enthalpieänderungen bei chemischen Reaktionen. Er wurde 1840 von Germain Henri Hess aufgestellt.
In vielen Fällen können Produkte einer chemischen Reaktion auf verschiedenen Wegen entstehen. Der Reaktionsweg hat dabei nach dem Energieerhaltungssatz keinen Einfluss auf die Energie, die bei einer Reaktion aufgenommen oder abgegeben wird. Für die Enthalpie einer chemischen Reaktion gilt dasselbe.
Hess'scher Wärmesatz
Die Enthalpieänderung ΔH eines Gesamtprozesses ist die Summe der Enthalpieänderungen der einzelnen Prozessschritte.
Aus dem Satz folgt, dass die Reaktionsenthalpie unabhängig vom Reaktionsweg ist und nur vom Anfangs- und vom Endzustand des Systems abhängt.
Beispiel
Graphit kann direkt zu Kohlenstoffdioxid verbrannt werden (1) oder indirekt über die Zwischenstufe Kohlenstoffmonoxid (2), (3). Die Gesamtreaktionsenthalpie ΔRH ist in beiden Fällen gleich:
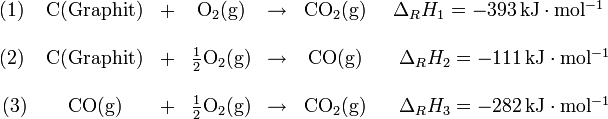
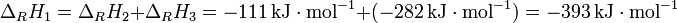
Literatur
- Chemie heute Sekundarbereich II, Schroedel Verlag, 1998, ISBN 3-507-10630-2
- Silberberg, Chemistry, The Molecular Nature of Matter and Change, Fourth Edition, Mc Graw Hill, 2006, ISBN 0-07-111658-3
Wikimedia Foundation.
