- Hexan-1,6-diol
-
Strukturformel 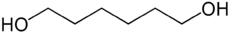
Allgemeines Name 1,6-Hexandiol Andere Namen Hexan-1,6-diol
Summenformel C6H14O2 CAS-Nummer 629-11-8 Kurzbeschreibung farblose Kristalle[1] Eigenschaften Molare Masse 118,18 g·mol−1 Aggregatzustand fest
Dichte 1,12 g/cm3 (20 °C)[1]
Schmelzpunkt Siedepunkt 253–260 °C[1]
Dampfdruck Löslichkeit sehr gut in Wasser (5000 g/l bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 3730 mg/kg (Ratte, oral)[1]
WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,6-Hexandiol ist eine chemische Verbindung aus der Gruppe der Diole. Sie besteht aus dem Grundgerüst des Hexans, an dessen terminalen Positionen sich Hydroxylgruppen befinden.
Inhaltsverzeichnis
Darstellung
Es existieren mannigfaltige Synthesemöglichkeiten für 1,6-Hexandiol. So kann es durch Reduktion von Adipinsäure mit Lithiumaluminiumhydrid[2] oder deren Ester mit elementarem Natrium[3] erhalten werden. Auch die Hydrolyse von 1,6-Dibromhexan[4] oder 1,6-Diiodhexan[5] liefern 1,6-Hexandiol. Weitere Möglichkeiten sind die Hydroborierung von 1,5-Hexadien[6] und die Ringöffnung von ε-Caprolacton.[7]
Eigenschaften
1,6-Hexandiol ist bei Raumtemperatur ein farbloser Feststoff, der bei 39–42 °C schmilzt. Er besitzt einen Flammpunkt von 147 °C und eine Zündtemperatur von 320 °C. Im Bereich von 6–16-Vol% können sich explosible Gemische bilden.[1]
Verwendung
1,6-Hexandiol kann zur Synthese von Oxepan verwendet werden. Hierzu wird es mit DMSO bei 190 °C cyclisiert.[8]
1,6-Diaminohexan kann durch die Reaktion mit Ammoniak bei erhöhter Temperatur und hohem Druck erhalten werden.[9]
Quellen
- ↑ a b c d e f g h i j Sicherheitsdatenblatt Merck
- ↑ E. Bernatek: Methylal as a Solvent in Lithium Aluminum Hydride Reductions., in: Acta Chem. Scand. 1954, 8, 874–875.
- ↑ Budesinsky, Rockova: Collect. Czech. Chem. Commun. 1957, 22, 811–813.
- ↑ E. Haworth, W. H. Perkin: Hexamethylene dibromide and its action on sodium and on ethylic sodio-malonate, in: J. Chem. Soc. 1894, 65, 591–602.
- ↑ Hamonet, Bull. Soc. Chim. Fr. 1905, 33, 530.
- ↑ H. C. Brown, G. Zweifel: The Hydroboration of Dienes. , in: J. Am. Chem. Soc. 1959, 81, 5832–5833.
- ↑ S. Kim, K. H. Ahn: Ate complex from diisobutylaluminum hydride and n-butyllithium as a powerful and selective reducing agent for the reduction of selected organic compounds containing various functional groups, in: J. Org. Chem. 1984, 49, 1717–1724.
- ↑ V. J. Traynelis, W. L. Hergenrother, H. T. Hanson, J. A. Valicenti: Dehydration of Alcohols, Diols, and Related Compounds in Dimethyl Sulfoxide., in: J. Org. Chem. 1964, 29, 123–129.
- ↑ US-Patent, Eastman Kodak Co., US 2412209 1943.
Wikimedia Foundation.