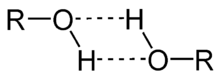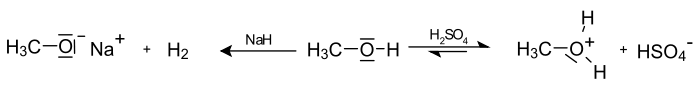- Alkohole
-
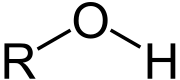 Die funktionelle Gruppe der Alkohole. R ist ein Alkyl-Rest jedoch kein Aryl-Rest, Acyl-Rest oder ein Heteroatom etc.).
Die funktionelle Gruppe der Alkohole. R ist ein Alkyl-Rest jedoch kein Aryl-Rest, Acyl-Rest oder ein Heteroatom etc.).
Als Alkohole (arabisch الكحول, DMG al-kuḥūl, oder الغول / al-ġawl: das Allerfeinste, reine Substanz, eigentlich: feines Antimonpulver) werden organisch-chemische Verbindungen benannt, die mindestens eine funktionelle Hydroxygruppe (–O–H) und an demselben Kohlenstoffatom keine höherwertigen Substituenten besitzen.
Alkohole, die sich von den Alkanen ableiten, werden nach IUPAC als Alkanole bezeichnet. Ethanol, umgangssprachlich nur als „Alkohol“ bezeichnet, ist namensgebend für die Gruppe der Alkohole.
Ist die Hydroxygruppe an ein Kohlenstoffatom gebunden, das Teil eines aromatischen Ringes ist, so werden die Verbindungen als Phenole bezeichnet. Phenole zählen nicht zu den Alkoholen[1][2], weil die Hydroxygruppe analog einer Carboxygruppe sauer reagiert.
Inhaltsverzeichnis
Nomenklatur und Einteilung
Der Name einfacher Alkohole ergibt sich als Zusammensetzung aus dem Namen des ursprünglichen Alkans, plus die Endung „-ol“. Zusätzlich wird die Position der OH-Gruppe durch eine vorangestellte Zahl verdeutlicht, zum Beispiel Propan-2-ol. Eine veraltete, bis 1957 gültige Bezeichnung für Alkohole ist – nach einem Vorschlag von Hermann Kolbe – Carbinole.[3]
Die Gruppe wird nach verschiedenen Kriterien (Zahl der Nichtwasserstoffnachbarn, Wertigkeit, Vorhandensein von Doppel-/Dreifachbindungen und Kettenlänge) eingeteilt.
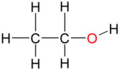
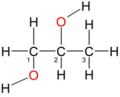
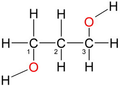
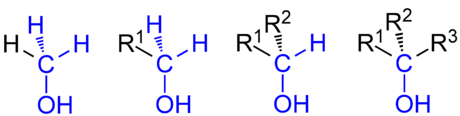 von links nach rechts: Methanol ein primärer Alkohol, die allgemeine Formel eines primären Alkohols, sowie die allgemeinen Formeln eines sekundären Alkohols und eines tertiären Alkohols. R1 bis R3 ist ein Organyl-Rest (Alkyl-Rest, Alkenyl-Rest, Aryl-Rest, Benzyl-Rest etc.). Blau markiert ist die kennzeichnende Gruppierung für primäre, sekundäre und tertiäre Alkohole.
von links nach rechts: Methanol ein primärer Alkohol, die allgemeine Formel eines primären Alkohols, sowie die allgemeinen Formeln eines sekundären Alkohols und eines tertiären Alkohols. R1 bis R3 ist ein Organyl-Rest (Alkyl-Rest, Alkenyl-Rest, Aryl-Rest, Benzyl-Rest etc.). Blau markiert ist die kennzeichnende Gruppierung für primäre, sekundäre und tertiäre Alkohole.
Zahl der Nichtwasserstoffnachbarn
Man unterscheidet Alkohole nach der Zahl der Nichtwasserstoffnachbarn des Kohlenstoffatoms, an welchem sich die Hydroxygruppe befindet. Bei primären Alkoholen trägt es zwei, bei sekundären ein und bei tertiären kein Wasserstoffatom. Ein Sonderfall ist das Methanol, das neben der Hydroxygruppe drei Wasserstoffatome am Kohlenstoffatom trägt.
Wertigkeit der Alkohole
Ist mehr als eine Hydroxygruppe in einem Alkoholmolekül vorhanden, wird deren Anzahl durch Einfügen einer der Anzahl der Hydroxygruppen entsprechenden griechischen Silbe (-di-, -tri-, usw.) vor der Endung -ol angegeben und man spricht von mehrwertigen Alkoholen. Ein Alkandiol ist das Ethan-1,2-diol (Trivialname Ethylenglycol), ein Alkantriol das Propan-1,2,3-triol (Trivialname Glycerin). Die Zahl vor der Endung -ol gibt die Position der funktionellen Gruppe(n) an. Dies gilt auch für einwertige Alkohole, zum Beispiel Propan-2-ol (Trivialname Isopropanol).
-
Strukturformel des Ethanols
-
Strukturformel Propan-1,2-diol
-
Strukturformel Propan-1,3-diol
Doppel- bzw. Dreifachbindungen
In Bezug auf das Vorhandensein von Doppel- bzw. Dreifachbindungen unterscheidet man Alkanole, Alkenole und Alkinole sowie den Spezialfall der meist instabilen Enole.
-
Strukturformel des Allylalkohols (2-Propen-1-ol)
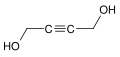
-
Strukturformel des Butindiols
-
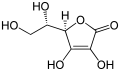
Strukturformel der Ascorbinsäure, eines Endiols
Kettenlänge
Über die Kettenlänge werden Alkohole ebenfalls unterschieden. Die Bezeichnung Fettalkohole verwendet man für Alkohole mit endständiger primärer –OH-Gruppe mit gerader Kette und einer Länge von sechs (Hexanol) bis hin zu 22 Kohlenstoffatomen (Behenylalkohol). Sie werden meist durch Reduktion der –COOH-Gruppe aus Fettsäuren gewonnen. Die höheren primären Alkohole mit 24 bis 36 Kohlenstoffatome bezeichnet man als Wachsalkohole.
Orbitalstruktur
In allen aliphatischen Alkoholen ist die Hydroxygruppe an ein sp3-hybridisiertes Kohlenstoffatom (C-Atom mit 4 Substituenten) gebunden. Ein Spezialfall sind die meist instabilen Enole, bei denen die Hydroxygruppe an ein sp2-hybridisiertes Kohlenstoffatom gebunden ist.
Physikalische Eigenschaften
Hohe Siedepunkte
Sauerstoff ist elektronegativer als Wasserstoff und Kohlenstoff, d. h. er zieht Elektronen stärker an als diese. Das führt zu einer unsymmetrischen Verteilung der Elektronen entlang der C–O–H-Bindung, man spricht von einer polaren Bindung, es bildet sich ein molekularer Dipol aus. Diese Dipole können untereinander Wasserstoffbrückenbindungen ausbilden, die die Anziehung der einzelnen Moleküle untereinander drastisch verstärken. Dies führt für Alkohole zu relativ hohen Siedepunkten gegenüber den um eine Methyleneinheit verlängerten Homologen ihrer Stammverbindung, die eine annähernd gleiche molarer Masse besitzen. So hat beispielsweise das unpolare Ethan (C2H6) (M = 30) einen Siedepunkt von −89 °C, während Methanol (CH3OH) (M = 32) diesen erst bei 65 °C erreicht.
Zusammenfassend:
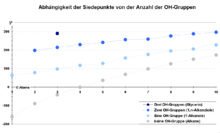
- Im Vergleich zu Alkanen mit einer vergleichbaren molaren Masse haben Alkohole einen höheren Schmelz- und Siedepunkt, da die Hydroxygruppe (OH-Gruppe) Wasserstoffbrückenbindungen ausbildet.
- Je mehr Hydroxygruppen ein Molekül aufweist, desto mehr Wasserstoffbrückenbindungen können ausgebildet werden und desto höher ist der Siedepunkt.
- Zwischen den Alkylresten bilden sich zusätzlich Van-der-Waals-Kräfte aus. Deswegen steigt der Siedepunkt mit der Länge des Alkylrestes
- Da die Stärke der Van-der-Waals-Wechselwirkungen nicht nur von der Größe des Alkylrestes, sondern auch von dessen Oberfläche abhängig ist, weisen stark verzweigte, eher kugelförmige Moleküle mit einer mittelständigen Hydroxygruppe einen niedrigeren Siedepunkt als unverzweigte, langgestreckte, primäre Alkohole auf.
Hydrophilie
Die OH-Gruppe ist ebenfalls in der Lage, Wasserstoffbrückenbindungen mit Wasser einzugehen. Sie erhöht damit die Hydrophilie, die Wasserlöslichkeit, der Verbindung. Organische Alkylreste selbst sind nicht wasserlöslich, also hydrophob. Die Wasserlöslichkeit sinkt daher mit der Größe des organischen Anteils und steigt mit der Zahl der Hydroxygruppen. Die Propanole und tert.-Butanol sind bei Raumtemperatur noch in jedem Verhältnis mit Wasser mischbar, alle langkettigeren Alkohole lösen sich nur noch in zunehmend kleinen Mengen. Größere Mengen gelöster anorganischer Salze können auch bei den kurzkettigen Alkoholen eine Phasentrennung bewirken („Salzfracht“).
Zusammenfassend:
- Die Hydroxygruppe eines Alkohols ist aufgrund der ungleichen Ladungsverteilung polar. Somit ist die Fähigkeit derselben, auch zu ebenfalls polaren Wassermolekülen Wasserstoffbrückenbindungen ausbilden zu können, für die gute Löslichkeit vor allem kurzkettiger Alkohole verantwortlich.
- Je mehr Hydroxygruppen ein Alkohol aufweist, desto mehr Wasserstoffbrücken können diese mit dem Wasser ausbilden. Daher steigt mit wachsender Anzahl der hydrophilen Hydroxygruppen die Wasserlöslichkeit.
- Diesem Effekt wirkt allerdings der hydrophobe, also wasserabweisende, unpolare Alkylrest entgegen: Je länger er ist, desto geringer ist die Wasserlöslichkeit des Alkohols.
Acidität
Der pKs-Wert (Säurestärke) von Alkoholen liegt bei etwa 15. Sie reagieren somit in wässriger Lösung näherungsweise neutral. Es ist möglich, sie mit einer starken Base zu deprotonieren. Die deprotonierte Form eines Alkohols heißt Alkoholat. Die Acidität von Alkoholen nimmt in der Reihe von Methanol über primäre, sekundäre und tertiäre Alkohole ab. Ebenso ist es möglich, sie in gewissem Umfang mit starken Säuren zu protonieren:
Industriell werden Alkoholate durch Umsetzung der entsprechenden Alkohole mit elementarem Natrium hergestellt:
Spektroskopie
Im IR-Spektrum von Alkoholen ist deutlich die breite Bande der O–H-Valenzschwingung im Bereich von 3200–3650 cm−1 zu erkennen. Die Breite des Peaks wird durch Wasserstoffbrückenbindungen mit Wassermolekülen verursacht und ist in Spektren von wasserfreien Alkoholen in einem engeren Bereich von 3620–3650 cm−1 zu finden.
Chemische Eigenschaften
Reaktion mit konz. Schwefelsäure
Unterhalb von 140 °C bildet sich der Ester der Schwefelsäure.
Bei etwa 140 °C findet die Kondensationsreaktion zu einem Ether statt.
Oberhalb von 170 °C werden primäre Alkohole zu Alkenen dehydratisiert. (Eliminierung)
Selenoxid-Eliminierung
Die Selenoxid-Eliminierung ist eine milde Variante der Eliminierung.
Veresterung
Mit Carbonsäuren reagieren Alkohole unter Wasserabgabe zu Estern, diese Reaktion wird auch Veresterung genannt. Diese Reaktion wird durch Säuren katalysiert.
Oxidation
Primäre Alkohole lassen sich zu Aldehyden, sekundäre Alkohole zu Ketonen oxidieren. Tertiäre Alkohole lassen sich nicht weiter oxidieren, es sei denn unter Zerstörung des Kohlenstoffgerüsts.
Oxidation eines primären Alkohols zu einem Aldehyd (Alkanal):
Oxidation eines sekundären Alkohols zu einem Keton:
Acetalbildung
Mit Aldehyden reagieren Alkohole in Gegenwart saurer Katalysatoren zu Halbacetalen bzw. Acetalen.
Nachweis von Alkoholen
Umsetzung mit metallischem Natrium
Wenn man zu einer flüssigen Alkoholprobe Natrium hinzufügt, so entsteht Wasserstoff, welches man mit der Knallgasprobe nachweisen kann. Diese Methode gilt zwar als Alkoholnachweis, ist jedoch nicht eindeutig, da alle ausreichend protischen Substanzen, zum Beispiel Carbonsäuren, anorganische Säuren oder Wasser, die gleiche Reaktion eingehen.
Alcotest
Der Umsatz von Alkoholen mit Dichromaten in schwefelsaurer Lösung ist geeignet, um Alkohole quantitativ nachzuweisen und wurde früher in den Alcotest-Röhrchen eingesetzt:
Das Nachweisprinzip beruht auf dem Farbumschlag von gelb-orange (saure Dichromatlösung) nach grün (Chrom(III)-Ionen) und kann spektralphotometrisch gemessen werden.
Certest
Eine weitere Möglichkeit besteht in der Umsetzung mit Cer(IV)-ammoniumnitrat. Hierbei wird eine konzentrierte Lösung von Cer(IV)-ammoniumnitrat mit einer verdünnten Lösung der unbekannten Substanz versetzt. Enthält die unbekannte Substanz Alkohol-Gruppen, färbt sich das Gemisch rot (manchmal auch grün). Enthält die Substanz Phenole, fällt ein brauner Niederschlag aus. Der Grund für diese Farbreaktion ist eine Komplexbildung, genauer gesagt eine Ligandensubstitution, bei der ein Alkohol/Phenol mit dem Sauerstoffatom am Cer(IV) koordiniert. Durch die Veränderung der Ligandensphäre verändert sich die Farbe des Cer(IV) von hellgelb zu rot/grün/braun. Leicht oxidierbare Alkohole/Phenole können einen negativen Nachweis ergeben, indem sie das Cer(IV) zu Cer(III) reduzieren.
Lucas-Probe
Der Nachweis des Substitutionsgrades eines Alkohols, also ob es sich dabei um einen primären, sekundären oder tertiären Alkohol handelt, erfolgt über nucleophile Substitution der OH-Gruppe gegen Chlorid durch die Lucas-Probe. Die Substitution hat zur Folge, dass sich die entstehende Substanz nicht mehr in Wasser löst und damit eine eigene Phase ausbildet. Dabei ist die Geschwindigkeit dieser Phasenbildung entscheidend:
- Tertiäre Alkohole reagieren bei Raumtemperatur sofort.
- Sekundäre Alkohole reagieren nach etwa fünf Minuten.
- Primäre Alkohole reagieren ausschließlich unter Erwärmen.
Voraussetzung für diesen Test ist, dass sich der ursprüngliche Alkohol in Wasser löst. Auch darf keine andere unter den Reaktionsbedingungen substituierbare Gruppe vorliegen.
Spektroskopie und Derivatisierung
Die eindeutige Identifizierung eines unbekannten Alkohols erfolgt entweder spektroskopisch oder durch Synthese eines charakteristischen Derivates, das einen Schmelzpunkt hat, der von den Schmelzpunkten gleicher Derivate ähnlicher Alkohole gut zu unterscheiden ist. Oftmals werden sie über Ester der 4-Nitrobenzoesäure oder der 3,5-Dinitrobenzoesäure identifiziert. Hierzu wird die zu analysierende Substanz in Gegenwart geringer Mengen Schwefelsäure umgesetzt. Die Schmelzpunkte dieser Derivate sind in der Regel scharf.
-
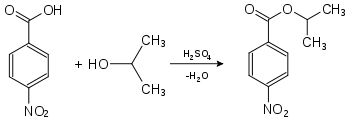
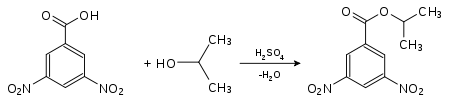
Nachweis von Isopropanol als Derivat der 4-Nitrobenzoesäure:
4-Nitrobenzoesäure-2-propylester (Smp.: 100,5 °C[4])Nachweis von Isopropanol als Derivat der 3,5-Dinitrobenzoesäure:
3,5-Dinitrobenzoesäure-2-propylester (Smp.: 123 °C[4])
Die Derivate der 3,5-Dinitrobenzoesäure besitzen in der Regel höhere Schmelzpunkte als die der 4-Nitrobenzoesäure.[4] Sie werden dann bevorzugt gewählt, wenn der Schmelzpunkt mit der 4-Nitrobenzoesäure zu niedrig ist und keine genaue Bestimmung mehr möglich wird.
Liste wichtiger Alkohole mit Schmelz- und Siedepunkten
Liste wichtiger Alkohole mit Schmelz- und SiedepunktenHomologe Reihe der einwertigen, primären, linearen, unverzweigten Alkohole C-Atome: Doppelbindungen Molare Masse in g/mol Systematischer Name Trivialname Schmelzpunkt in °C Siedetemperatur in °C Löslichkeit in g/l 1: 0 32,0 Methanol Holzgeist, Methylalkohol −97,8 64,7[5] ∞ 2: 0 46,1 Ethanol Alkohol, Ethylalkohol, Weingeist −114,1 78,3[5] ∞ 3: 0 60,1 Propan-1-ol n-Propylalkohol −126,2 97,2[5] ∞ 4: 0 74,1 Butan-1-ol n-Butylalkohol −89,3 117,3[5] 79 5: 0 88,2 Pentan-1-ol n-Amylalkohol −78,2 138[6] 23 6: 0 102,2 Hexan-1-ol n-Hexylalkohol −48,6 157,5[7] 6 7: 0 116,2 Heptan-1-ol −34,0 176[8] 2 8: 0 131,2 Octan-1-ol −14,9 194,5[7] 0,5 9: 0 144,3 Nonan-1-ol −6 [9] 214 - 216 [10] 0 10: 0 158,3 Decan-1-ol 7 [11] 228[8] 0 11: 0 172,3 Undecan-1-ol 11-16 243[12] 0 12: 0 186,3 Dodecan-1-ol Laurylalkohol 24 259[8] 0 13: 0 200,4 Tridecan-1-ol 32−33[13] 274–280 0 14: 0 214,4 Tetradecan-1-ol Myristylalkohol 39−40[14] 289 0 15: 0 228,4 Pentadecan-1-ol 44 270 0 16: 0 242,4 Hexadecan-1-ol Cetylalkohol 50[15] 344[15] 0 … 18: 0 268,5 Octadecan-1-ol Stearylalkohol 56–59[16] 336 0 … 26: 0 382,4 Hexacosan-1-ol Cerylalkohol 79–81 240 (13 Pa) 0 … 30: 0 438,8 1-Triacontanol Myricylalkohol 88[17] 0 einwertige Alkohole: sekundär und tertiär, primär mit verzweigten Ketten Anzahl der C-Atome Molare Masse in g/mol Systematischer Name Trivialname Schmelzpunkt in °C Siedetemperatur in °C Löslichkeit in g/l 3 60,1 Propan-2-ol Isopropylalkohol, Isopropanol −88,5 82,3[5] ∞ 4 74,1 Butan-2-ol Sekundärer Butylalkohol −114,7 99,5[18] 125 4 74,1 2-Methylpropan-1-ol Isobutylalkohol −108 108[19] 100 4 74,1 2-Methylpropan-2-ol Tertiärer Butylalkohol, Trimethylcarbinol 25,5[20] 82,3[20] ∞ 5 88,2 Pentan-2-ol sek-n-Amylalkohol −50 118,9[21] 166 5 88,2 Pentan-3-ol Diethylcarbinol −8 116,1[22] 55 (30 °C) 5 88,2 2-Methylbutan-1-ol −70 129[23] 36 5 88,2 3-Methylbutan-1-ol Isoamylalkohol −117 130,8 20 5 88,2 2-Methylbutan-2-ol −8,4 102[24] 5 88,2 3-Methylbutan-2-ol 112,9[24] 5 83,2 2,2-Dimethylpropan-1-ol neo-Pentylalkohol, tertiärer Amylalkohol −12 102 125 mehrwertige Alkohole Anzahl der C-Atome Molare Masse in g/mol Systematischer Name Trivialname Schmelzpunkt in °C Siedetemperatur in °C Löslichkeit in g/l 2 62,1 Ethan-1,2-diol Ethylenglycol, 1,2-Glycol −15,6 197,2[5] ∞ 3 76 1,2-Propandiol Propylenglycol −68 188 ∞ 3 76 Propan-1,3-diol Trimethylenglycol −32 215 ∞ 4 90 Butan-1,2-diol 1,2-Butylenglycol -114 192 ∞ 4 90 Butan-1,3-diol 1,3-Butylenglycol <−50 207,5 ∞ 4 90 1,4-Butandiol Tetramethylenglycol 16 230 ∞ 4 90 2,3-Butandiol 2,3-Butylenglycol 34(meso) 183(meso) ∞ 5 104 Pentan-1,5-diol Pentamethylenglycol −16 241 ∞ 6 118 Hexan-1,6-diol Hexamethylenglycol 39–42 253–260 5000 8 146 Octan-1,8-diol Octamethylenglycol 58–61 171–173 (27 hPa) 9 160 Nonan-1,9-diol Nonamethylenglycol 45–46 288 9 10 174 Decan-1,10-diol Decamethylenglycol 72 297 0,7 3 104 Propan-1,2,3-triol Glycerin, Glycerol 18 290 ∞ weitere Alkohole Anzahl der C-Atome Molare Masse in g/mol Systematischer Name Trivialname Schmelzpunkt in °C Siedetemperatur in °C Löslichkeit in g/l 5 86,13 Cyclopentanol −19 141 13 [25] 6 100,2 Cyclohexanol 25,2 161,5[5] 36 3: 1 58 Prop-2-en-1-ol Allylalkohol −129 97 ∞ 4: 1 71 But-2-en-1-ol Crotylalkohol −30 118 166 7 108,14 Phenylmethanol, (Hydroxymethyl)benzen Benzylalkohol −15 205,4[5] 39 8 122,14 1-Phenylethan-1-ol, (1-Hydroxyethyl)benzol (C6H5CH(OH)CH3) alpha-Phenylethylalkohol 21 205 0 8 122,14 2-Phenylethan-1-ol, (2-Hydroxyethyl)benzol (C6H5CH2CH2OH) beta-Phenylethylalkohol −27 221 16 13 184,23 Diphenylmethanol (C6H5)2CHOH) Diphenyltricarbinol, Benzhydrol 69 298 0 19 260,33 Triphenylmethanol (C6H5)3COH) Triphenylcarbinol 162,5 >360 0 Zum Vergleich das Phenol und Alkohole mit ähnlichen Molmassen Anzahl der C-Atome Molare Masse in g/mol Systematischer Name Trivialname Schmelzpunkt in °C Siedetemperatur in °C Löslichkeit in g/l 6 94,1 Phenol Carbolsäure, Benzenol 41 181,7[5] 84 5 88,2 Pentan-1-ol n-Amylalkohol −78,2 128,0 23 6 102,2 Hexan-1-ol n-Hexylalkohol −48,6 157,1 6 5 86,13 Cyclopentanol −19 141 13 6 100,2 Cyclohexanol 25,2 161,5[5] 36 - Anmerkung
- * bei Siedepunkt: Die Substanz zersetzt sich vor Erreichen des Siedepunktes. Werte in Klammern geben den Siedepunkt bei 20 hPa Druck an.
- ∞ bei Löslichkeit: unbegrenzt mit Wasser mischbar.
Bei einzelnen Werten kann es in der Literatur zu Abweichungen kommen. (Siehe Diskussionsseite)
Einzelnachweise
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 44.
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, Frank'sche Verlagshandlung, Stuttgart 1983, 8. Auflage, S. 122−123, ISBN 3-440-04513-7.
- ↑ Science Vision, Jg. 3, Nr. 25, März 2000 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b c d e f g h i j Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 312, ISBN 3-342-00280-8.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. Auflage, 1991, S. 120, ISBN 3-7776-0485-2.
- ↑ a b Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. Auflage, 1991, S. 124, ISBN 3-7776-0485-2.
- ↑ a b c Hans Rudolf Christensen: Grundlagen der organischen Chemie, Verlag Sauerländer Aarau, 1. Auflage, 1970, S. 166.
- ↑ Eintrag zu CAS-Nr. 143-08-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. April 2008 (JavaScript erforderlich).
- ↑ Datenblatt 1-Nonanol bei Merck, abgerufen am 1. November 2010.
- ↑ Eintrag zu CAS-Nr. 112-30-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Januar 2008 (JavaScript erforderlich).
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-537, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-531, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-507, ISBN 0-8493-0740-6.
- ↑ a b Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-301, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-496, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-355, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-169, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-446, ISBN 0-8493-0740-6.
- ↑ a b Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-447, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-396, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-397, ISBN 0-8493-0740-6.
- ↑ Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-168, ISBN 0-8493-0740-6.
- ↑ a b Robert C. Weast (Herausgeber): CRC Handbook of Chemistry and Physics, 1st Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-169, ISBN 0-8493-0740-6.
- ↑ Cyclopentanol bei ChemIDplus.
Weblinks
- Mitschnitte von Vorlesungen der Universität Tübingen, Experimentalchemie II, Organische Chemie.
- Schulversuche zum Thema Alkohole
- Lernzirkel Alkohole. ZUM-Wiki. Zentrale für Unterrichtsmedien im Internet e. V. [ZUM Internet e. V.] (28. Dezember 2009). Archiviert vom Original am 28. Dezember 2009. Abgerufen am 7. Februar 2010.
-
Wikimedia Foundation.