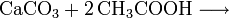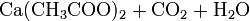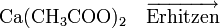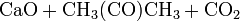- 2-Propanon
-
Strukturformel 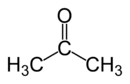
Allgemeines Name Aceton Andere Namen - Propanon
- Propan-2-on
- 2-Propanon
- Dimethylketon
Summenformel C3H6O CAS-Nummer 67-64-1 PubChem 180 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 58,08 g·mol−1 Aggregatzustand flüssig
Dichte 0,79 g·cm−3 (20 °C) [1]
Schmelzpunkt -95 °C [1]
Siedepunkt 56 °C [1]
Dampfdruck Löslichkeit mischbar mit Wasser[1], gut löslich in vielen organischen Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-36-66-67 S: (2)-9-16-26-46 MAK 500 ml/m3, 1200 mg/m3[1]
LD50 5.800 mg/kg (Ratte oral);
20.000 mg/kg (Kaninchen dermal)WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Aceton (unüblich Azeton) ist der Trivialname für Propanon bzw. Dimethylketon. Aceton ist eine farblose Flüssigkeit und findet Verwendung als aprotisches Lösemittel und als Ausgangsstoff für viele Synthesen der organischen Chemie. Es mit seinem Strukturmerkmal der Carbonylgruppe (>C=O), die zwei Methylgruppen trägt, das einfachste Keton.
Inhaltsverzeichnis
Eigenschaften
Aceton ist eine farblose, niedrigviskose Flüssigkeit mit charakteristischem Geruch, leicht entzündlich und bildet mit Luft ein explosives Gemisch. Es ist in jedem Verhältnis mit Wasser und den meisten organischen Lösungsmitteln mischbar. Das Acetonmolekül zeigt Keto-Enol-Tautomerie; sein pKs-Wert beträgt 20.
Herstellung
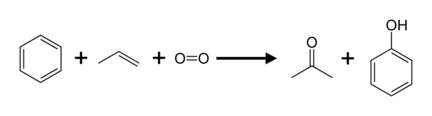
Das wichtigste Herstellungsverfahren von Aceton ist das Cumolhydroperoxid-Verfahren, das auch als Phenolsynthese nach Hock bekannt ist:
Hier werden Benzol und Propen zunächst durch eine Friedel-Crafts-Alkylierung im Sauren in Isopropylbenzol (Cumol) überführt. Dieses reagiert dann mit Sauerstoff in einer Radikalreaktion zum Hydroperoxid, welches sich während der sauren Aufarbeitung zu Phenol und Aceton zersetzt.
Als weiteres Herstellungsverfahren wird die Dehydrierung bzw. Oxidehydrierung von Isopropanol durchgeführt.
Eine weitere Möglichkeit der Acetondarstellung besteht darin, Calciumacetat zu erhitzen, wobei es in Aceton und Calciumoxid zerfällt. (Bekannt unter der Bezeichnung "Kalksalzdestillation")
Reaktionen
Als besondere Reaktion sei hier die Iodierung von Aceton als klassisches Beispiel für eine Reaktionskinetik pseudo-nullter Ordnung genannt. Da sich nur die Enolform iodieren lässt, Aceton aber nahezu zu 100% als Keton vorliegt, kann man bei der Reaktion die Konzentration an 2-Propenol als konstant ansehen. Dessen C=C-Doppelbindung reagiert nun mit Iod unter Abspaltung eines Iodidions zu einem mesomeren Kation, das anschließend ein Proton auf ein Iodidion überträgt[3].

Die Einstellung des Keto-Enol-Gleichgewichts ist säure- (und auch basen-) -katalysiert. Durch den entstehenden Iodwasserstoff wird die Iodierung daher stark beschleunigt (Autokatalyse). Bei Zugabe von Base läuft hingegen die Iodoformreaktion ab.
Verwendung
Aceton wird als gängiges Lösungs- und Extraktionsmittel für Harze, Fette und Öle, Kolophonium, Celluloseacetat sowie als Nagellackentferner eingesetzt. Es löst ein Vielfaches seines Volumens an Ethin (Acetylen). Aceton wird in vielen Reaktionen (Aldoladditionen und Aldolkondensationen) der organischen Chemie benutzt und ist in der Lehre oft ein Standardmolekül für Beispiele zur Chemie der Ketone.
Lässt man je zwei Acetonmoleküle unter dem Einfluss basischer Reagenzien aldolartig dimerisieren, so entsteht Diacetonalkohol.
Aceton reagiert mit Wasserstoffperoxid zu dem explosiven Acetonperoxid.
In einigen Ländern wird Aceton in kleinen Anteilen (1:2000-1:5000) Benzin oder Diesel zugesetzt, um eine vollständigere Verbrennung des Treibstoffs zu erreichen.
Mit Aceton werden auch Tonköpfe einer Tonbandmaschine gereinigt.
In der fotochemischen Leiterplattenherstellung wird Aceton zum abschließenden Reinigen der Leiterplatte eingesetzt.
Biochemie
Aceton ist ein Ketonkörper, der nicht in nennenswertem Umfang verstoffwechselt werden kann. Er wird deshalb über die Lunge oder im Ausnahmefall über den Harn abgegeben (Acetonurie, ein Symptom des Diabetes mellitus). Andere Ketonkörper sind Acetylaceton und Hydroxymethylbutyrat. Diese können im Stoffwechsel verarbeitet werden.
Komplexchemie
Aceton kann aufgrund seiner polaren Carbonylgruppe mit Kationen auch Komplexverbindungen bilden.
Toxikologie
Auf der Haut verursacht es Trockenheit, da es sie entfettet. Deshalb sollte man betroffene Stellen nach Kontakt mit Aceton etwas einfetten. Inhalation größerer Dosen erzeugt Bronchialreizung, Müdigkeit und Kopfschmerz. Sehr hohe Dosen wirken narkotisch.
Quellen
- ↑ a b c d e f g Eintrag zu CAS-Nr. 67-64-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8. Januar 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 67-64-1 im European chemical Substances Information System ESIS
- ↑ F. A. Carey, R. J. Sundberg, Organische Chemie, Wiley-VCH Verlag 2004 ISBN 3-527-29217-9
Weblinks
Wikimedia Foundation.