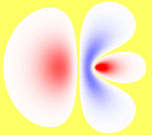
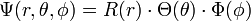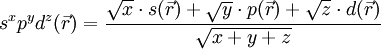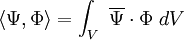- Hybrid-Orbital
-
Ein Hybridorbital ist ein Orbital, das rechnerisch aus einer Linearkombination der Wellenfunktionen der grundlegenden Atomorbitale entsteht. Diesen Modellierungsvorgang nennt man Hybridisierung der Orbitale. Das Konzept wurde von Linus Pauling um 1931 entwickelt.
Inhaltsverzeichnis
Mechanismus
Die durch die Berechnung der Aufenthaltswahrscheinlichkeit der jeweiligen Elektronen erzeugten Orbitale stimmen nicht immer mit den aufgrund chemischer Eigenschaften zu vermutenden Formen überein. So stellt man fest, dass das Kohlenstoffatom in der äußeren Elektronenschale zwei s- und zwei p-Elektronen besitzt. Dementsprechend müssten diese Orbitale bei den C-H-Bindungen im Methan (CH4) zu unterschiedlichen Bindungen führen. Tatsächlich stellt man aber fest, dass die vier Bindungen gleichartig und nicht unterscheidbar sind. Dies kann man durch sp3-Hybridisierung erklären: Das doppelt besetzte, kugelförmige 2s-Orbital wird mit den hantelförmigen 2p-Orbitalen (2 einfach besetzt, eins unbesetzt) zu vier gleichen, keulenförmigen sp3-Hybridorbitalen kombiniert, die mit je einem Elektron besetzt sind. Diese richten sich tetraedrisch im Raum aus und bilden mit den 1s-Elektronen des Wasserstoffs gleichartige Atombindungen. Das so entstandene Modell entspricht den beobachteten Eigenschaften des Methans.
Carbokationen (Carbeniumionen) sind grundsätzlich sp2-hybridisiert, damit das leere Orbital 100 % p-Charakter hat und somit kein s-Anteil „verschwendet“ wird (Bentsche Regel).
Physikalische Interpretation
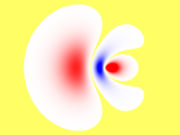
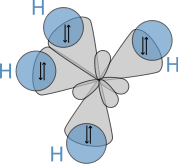 sp3 Hybridisierung bei Methan.
sp3 Hybridisierung bei Methan.Orbitale ergeben sich als Lösung des Einelektronenproblems (Wasserstoffatom) in der Quantenmechanik. Dabei sind die Orbitale aus der gleichen Hauptschale bezüglich des Drehimpulses entartet. Das bedeutet, jede Überlagerung von Wellenfunktionen der gleichen Schale mit unterschiedlichem Drehimpuls ist wieder eine Lösung und beschreibt somit ein mögliches Orbital. Während die Entartung in einem freien Atom durch die Spin-Bahn-Wechselwirkung aufgehoben ist und damit Orbitale mit unterschiedlichem Gesamtdrehimpuls unterschiedliche Energieeigenwerte haben, hebt in Molekülen der Einfluss der elektrischen Felder der Nachbaratome die Entartung der Orbitale auf. In Molekülen treten somit Hybridorbitale als energetisch günstigere Überlagerungen von Orbitalen mit unterschiedlichem Bahndrehimpuls auf.
Die Hybridorbitale bilden wie alle an Atombindungen beteiligten Orbitale durch Mischung mit den Orbitalen der Nachbarmoleküle Molekülorbitale.
Mathematische Betrachtung
Zur Lösung der Einelektronen-Schrödingergleichung wird üblicherweise ein Produktansatz gemacht, ein Verfahren, das sich häufig zur Lösung von Differentialgleichungen 2. Ordnung eignet. Die Wellenfunktion Ψ, die sich zuerst beliebig aus Kugelkoordinaten (r, θ, φ) zusammensetzt wird als Produkt angeschrieben.
Dadurch gehen alle Lösungen verloren, die sich nicht als derartiges Produkt schreiben lassen. Lösungen, die beim Produktansatz verloren gehen, können durch Linearkombination der erhaltenen Lösung rückgewonnen werden. Beliebige Linearkombinationen zur gleichen Energie (und damit gleichen Hauptquantenzahl) sind wegen der Linearität des Hamiltonoperators auch exakte Lösungen der Einelektronen-Schrödingergleichung. Sie werden als Hybridorbitale bezeichnet.
Seien
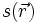 ,
, 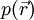 und
und 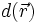 die Wellenfunktionen eines s-, p- bzw. d-Orbitals gleicher Quantenzahl. Die Wellenfunktion eines Hybridorbitals
die Wellenfunktionen eines s-, p- bzw. d-Orbitals gleicher Quantenzahl. Die Wellenfunktion eines Hybridorbitals 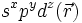 wird dann folgendermaßen gebildet.
wird dann folgendermaßen gebildet.Die hochgestellten Zahlen geben den quadrierten Anteil des Atomorbitals am Hybridorbital wieder.
Die Wellenfunktionen in komplexeren Systemen verhalten sich ähnlich. Dort werden jedoch auch Wellenfunktionen unterschiedlicher Hauptquantenzahl kombiniert. Ähnliche Energie ist entscheidend.
Soll ein ganzer Satz von Hybridorbitalen gebildet werden, ist zu beachten, dass die Transformationsmatrix eine unitäre Matrix (reeller Spezialfall: Orthogonalmatrix) sein muss. Das bedeutet, dass die Hybridorbitale wieder eine Orthonormalbasis bilden müssen. Das zugehörige Skalarprodukt ist:
Beispiele
sp sp2 sp3 linear trigonal-planar tetraedrisch HgCl2, Ethin, CO2 BF3, Graphit, Ethen CH4, Diamant dp sd3 dsp2 linear tetraedrisch quadratisch , CrO42- [AuCl4]-, [NiCN4]2- sp3d sp3d2 sp3d3 trigonal-bipyramidal oktaedrisch pentagonal-bipyramidal PF5 SF6 IF7 Quellen
- Wolfgang Demtröder: Experimentalphysik 3. Atome, Moleküle und Festkörper. 3. Auflage. Springer-Verlag, Berlin/Heidelberg 2000, ISBN 3-540-66790-3.
- Erwin Riedel: Anorganische Chemie. 4. Auflage. Walter de Gruyter, New York 2002, ISBN 3-110-16602-X.
- Henry A. Bent: An Appraisal of Valence-bond Structures and Hybridization in Compounds of the First-row elements.. In: Chemical Reviews. 61, Nr. 3, 1961, S. 275–311 (doi:10.1021/cr60211a005).
Siehe auch
Wikimedia Foundation.