- Interleukin 8
-
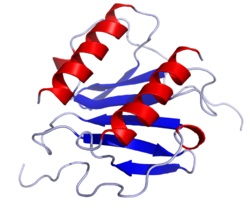
CXCL8 Bändermodell des CXCL8 als Dimer nach PDB 1il8 --> Vorhandene Strukturdaten: 1icw, 1ikl, 1ilp, 1ilq, 1qe6, 2il8, 3il8 Größe 72 AS; 8,4 kDa Precursor 99 AS Bezeichner Gen-Namen IL8; CXCL8; MDNCF; NAP-1; MONAP; GCP-1; Emoctakin Externe IDs OMIM: 146930 UniProt: P10145 MGI: - Vorkommen Homologie-Familie Small inducible cytokine Übergeordnetes Taxon Wirbeltiere Ausnahmen Maus CXCL8 (für CXC-Motiv-Chemokin 8) oder Interleukin-8 (kurz: IL-8) ist ein körpereigener Botenstoff aus der Gruppe der CXC-Motiv-Chemokine. CXCL8 wird insbesondere von Endothelzellen, Monozyten, Epithelzellen und Fibroblasten produziert. Als Entzündungsmediator ist dieses Zytokin bei der chemotaktischen Rekrutierung von Leukozyten, insbesondere neutrophile Granulozyten in das entzündete Gewebe involviert. Darüber hinaus ist CXCL8 ein Angiogenesefaktor[1] und ist als solcher an der Bildung und Neubildung von Blutgefäßen beteiligt.
Inhaltsverzeichnis
Biochemie
Genetik
Das Cxcl8-Gen des Menschen auf dem Chromosom 4 in der CXC-Chemokin-Clusterregion auf dem Genlocus 4q13-21 codiert ein aus 99 Aminosäuren bestehendes Präcursorprotein. Ebenso findet sich eine regulatorische Sequenz mit Bindungsstellen für die Transkriptionsfaktoren AP-1, NF-κB, C/EBP, die der Kontrolle der Genexpression dient[2]. Die Proteinbiosynthese von CXCL8 wird somit von Aktivatoren dieser Transkriptionsfaktoren, wie Interleukin 1, Interleukin 3, Interleukin 6, Tumornekrosefaktor-α, Interferon-γ, GM-CSF, Lipopolysaccharide, reaktive Sauerstoffspezies und andere zelluläre Stressfaktoren, induziert[3], während die anti-inflammatorischen Zytokine Interleukin 4 und Interleukin 10 seine Biosynthese hemmen[4].
Proteinstruktur
Aus dem aus 99 Aminosäuren bestehenden Präcursorprotein wird nach Abspaltung einer Signalsequenz eine aus 79 Aminosäuren bestehende Form von CXCL8 freigesetzt. Dieses Peptid unterliegt an seinem N-Terminus weiteren extrazellulären Modifikationen, sodass verschiedene funktionsfähige Isoformen mit 69 bis 79 Aminosäuren gebildet werden. Die dominierende, vom Immunzellen produzierte Variante besteht aus 72 Aminosäuren, während eine aus 77 Aminosäuren bestehende Variante vorwiegend von Nicht-Immunzellen produziert wird[5].
Wie fast alle Chemokine ist CXCL8 ein basisches Peptid. Es beinhaltet vier konservierte Cysteine die über je zwei Disulfidbrücken verbunden sind[5]. CXCL8 liegt in relevanter Menge als Dimer vor[6], wobei die monomere Form des Proteins für seinen biologische Wirkung ausreichend ist[7].
Signaltransduktion
CXCL8 vermittelt seine Effekte über eine Bindung an und Aktivierung der G-Protein-gekoppelten Rezeptoren CXCR1 und CXCR2. Über eine Aktivierung von G-Proteinen lösen diese Rezeptoren eine Signaltransduktionskaskade aus, die eine Aktivierung von Adenylylcyclasen, MAP-Kinasen und einen intrazellulären Anstieg der Ca2+-Konzentration einschließen. Darüber hinaus bindet CXCL8 an den strukturverwandten Duffy antigen receptor for cytokines (DARC). Dessen Funktion ist jedoch weitgehend ungeklärt.
Funktion
Immunsystem
Ein wichtiger Angriffspunkt des Chemokins sind neutrophile Granulozyten. Die wesentlichen biologischen Wirkungen von IL-8 auf Granulozyten beinhalten die Förderung der Chemotaxis, die Stimulation der Expression von Adhäsionsmolekülen und die Aktivierung mit Freisetzung von Sauerstoffradikalen und Granula, die über die Chemokinrezeptoren CXCR1 und CXCR2 vermittelt werden.
Angiogenese
Der pro-angiogenetische Effekt von CXCL8 beruht der Wirkung auf Endothelzellen. Als chemotaktisches Zytokin fördert CXCL8 die Migration von Endothelzellen in die Extrazellularmatrix des Gewebes. Gleichzeitig wirkt CXCL8 anti-apoptotisch auf Endothelzellen und fördert deren Proliferation unter Bildung von Kapillarstrukturen. Dieser Mechanismus wird durch die CXCL8-induzierte Freisetzung von Extrazellularmatrix-zersetzenden Metalloproteasen aufrechterhalten[8]. Dieser Effekt spielt während der Menstruation und der Wundheilung eine wichtige Rolle. Auch für die Versorgung und damit das Wachstum von Tumoren ist der pro-angiogenetische Effekt von entscheidender Bedeutung.
Einzelnachweise
- ↑ Brat DJ, Bellail AC, Van Meir EG: The role of interleukin-8 and its receptors in gliomagenesis and tumoral angiogenesis. In: Neuro-oncology. 7, Nr. 2, April 2005, S. 122–33. doi:10.1215/S1152851704001061. PMID 15831231
- ↑ Hoffmann E, Dittrich-Breiholz O, Holtmann H, Kracht M: Multiple control of interleukin-8 gene expression. In: J. Leukoc. Biol.. 72, Nr. 5, November 2002, S. 847–55. PMID 12429706
- ↑ Baggiolini M, Dewald B, Moser B: Interleukin-8 and related chemotactic cytokines--CXC and CC chemokines. In: Adv. Immunol.. 55, 1994, S. 97–179. PMID 8304236
- ↑ Xie K: Interleukin-8 and human cancer biology. In: Cytokine Growth Factor Rev.. 12, Nr. 4, December 2001, S. 375–91. PMID 11544106
- ↑ a b Baggiolini M, Clark-Lewis I: Interleukin-8, a chemotactic and inflammatory cytokine. In: FEBS Lett.. 307, Nr. 1, July 1992, S. 97–101. PMID 1639201
- ↑ Baldwin ET, Weber IT, St Charles R, et al: Crystal structure of interleukin 8: symbiosis of NMR and crystallography. In: Proc. Natl. Acad. Sci. U.S.A.. 88, Nr. 2, January 1991, S. 502–6. PMID 1988949
- ↑ Rajarathnam K, Sykes BD, Kay CM, et al: Neutrophil activation by monomeric interleukin-8. In: Science (journal). 264, Nr. 5155, April 1994, S. 90–2. PMID 8140420
- ↑ Li A, Dubey S, Varney ML, Dave BJ, Singh RK: IL-8 directly enhanced endothelial cell survival, proliferation, and matrix metalloproteinases production and regulated angiogenesis. In: J. Immunol.. 170, Nr. 6, March 2003, S. 3369–76. PMID 12626597
Wikimedia Foundation.