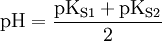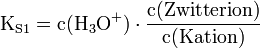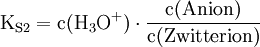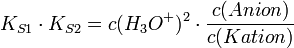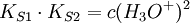- Isoelektrisch
-
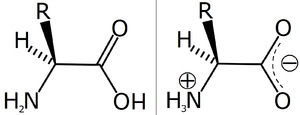 Eine Aminosäure, links in unionisiertem Zustand, rechts als Zwitterion
Eine Aminosäure, links in unionisiertem Zustand, rechts als ZwitterionEin Zwitterion (siehe auch Ion) ist ein Molekül mit zwei oder mehreren funktionellen Gruppen, von denen eine positiv und eine andere negativ geladen ist. Oft ist das Molekül dann insgesamt elektrisch neutral. Teilweise wird auch der Begriff "inneres Salz" für ein Zwitterion verwendet.
Meist handelt es sich bei den Gruppen um eine Säure- und eine Basenfunktion. Das bekannteste Beispiel sind Aminosäuren, die sowohl in wässriger Lösung als auch in der festen Phase zwitterionisch vorliegen. Die Säuregruppe gibt ein Wasserstoffion ab und trägt eine negative Ladung, die Aminogruppe nimmt ein Wasserstoffion auf und trägt eine positive Ladung. Im Unterschied zu Betainen lassen sich die Ladungen also durch Protonenwanderung ausgleichen.
In Lösung sind bei einem bestimmten pH-Wert, dem isoelektrischen Punkt (IEP oder pI), gleich viele Säuregruppen negativ geladen wie Aminogruppen positiv. Dann wandern Aminosäuren im elektrischen Feld nicht mehr sondern richten sich nur aus, da die Summenladung neutral ist. Liegt der pH-Wert unter dem isoelektrischen Punkt, nimmt die Dissoziation der Säuregruppe ab, und die Aminosäure trägt eine positive Summenladung. Liegt der pH-Wert darüber, nimmt die Dissoziation der Säure zu, und die Aminogruppe gibt das Wasserstoffion ab, das Molekül trägt eine negative Summenladung. Diesen Effekt nutzt man bei der Elektrophorese bzw. bei der isolektrischen Fokussierung.
Der pH-Wert am isoelektrischen Punkt lässt sich aus den pKs-Werten der Säuregruppe sowie der Aminogruppe berechnen:
Herleitung:
Die Säurekonstanten sind definiert als:
Gleichung 1 löst man nach c(Zwitterion) auf und setzt das Ergebnis in Gleichung 2 ein.
Da am isoelektrischen Punkt die Konzentrationen von Anion und Kation gleich sind, vereinfacht sich die Gleichung zu:
Wurzelziehen und logarithmieren ergibt dann:
Bei sauren oder basischen Aminosäuren werden zur Berechnung des IEPs die pKs-Werte der beiden Carboxylgruppen bzw. Aminogruppen berücksichtigt.
Am isoelektrischen Punkt ist die Wasserlöslichkeit von Aminosäuren am geringsten, da aufgrund der entstandenen intramolekularen Ladungen keine stabile Hydrathülle mehr gebildet werden kann.
Siehe auch
Wikimedia Foundation.