- Kalziumzitrat
-
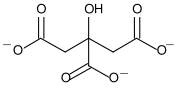
Strukturformel 
Allgemeines Name Calciumcitrat Andere Namen - Tricalciumcitrat
- TCC
- Tricalciumdicitrat
- Tricalcium-di-[2-hydroxy- 1,2,3-propantricarboxylat]- Tetrahydrat
- E 333
Summenformel C12H10Ca3O14 CAS-Nummer 813-94-5 (wasserfrei)
5785-44-4 (Tetrahydrat)ATC-Code A12AA09
Kurzbeschreibung weißer, geruchloser, kristalliner Feststoff Eigenschaften Molare Masse 570,5 g·mol−1 (Tetrahydrat) Aggregatzustand fest
Löslichkeit gering löslich in Wasser; unlöslich in Ethanol; leicht löslich in verdünnten Säuren
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumcitrat, ein Salz der Citronensäure, ist ein weißer, geruchloser, geschmacksneutraler, kristalliner Feststoff.
Inhaltsverzeichnis
Gewinnung und Darstellung
Die Herstellung erfolgt durch Neutralisation von Citronensäure mittels einer Calciumquelle wie Calciumhydroxid. Bei dieser exothermen Fällungsreaktion werden pro Teil Calciumcitrat vier Moleküle Wasser („Kristallwasser“) gebunden.
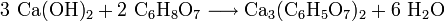
- Calciumhydroxid und Citronensäure reagieren zu Tricalciumdicitrat und Wasser.
Eigenschaften
Der Calciumgehalt beträgt 21 %. Die Wasserlöslichkeit steigt mit sinkender Temperatur (inverse Löslichkeit) und sinkendem pH-Wert. Aufgrund der organischen Citronensäure und der damit verbundenen höheren Löslichkeit ist die Bioverfügbarkeit des enthaltenen Calciums höher als bei den anorganischen Calciumsalzen wie Calciumcarbonat, Calciumphosphat.
Verwendung
Neben dem lange bekannten positiven Einfluss von Calcium auf die Knochendichte (s. Osteoporose), zeigen neuere Untersuchungen, dass bei einer ausreichenden Calciumzufuhr auch das Risiko für Übergewicht und Fettleibigkeit sinkt. Aus diesen Gründen wird Calciumcitrat Nahrungsmitteln zur Calciumanreicherung zugesetzt und für Nahrungsergänzungsmittel (Functional Food) verwendet. Es wird aber auch als Säureregulator und Stabilisator und in Arznei-, Futter- und Zahnpflegemitteln eingesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 333 zugelassen.
Quellen
Literatur und Weblinks
- Römpp Chemielexikon, 9. Aufl. (Herausgeber: Falbe/Regitz), S. 553
- Kurt Schreier, Hans Wolf: Untersuchungen über den Einfluß der Citronensäure auf den Calciumstoffwechsel. European Journal of Pediatrics, Vol. 67, No. 5 (1950) 526–544
- HJ Heller, LG Greer, SD Haynes, Poindexter JR, and CY Pak: Pharmacokinetic and pharmacodynamic comparison of two calcium supplements in postmenopausal women. Journal of C linical Pharmacology, Vol. 40 (2000) 1237–1244
- Davies KM, Heaney RP, Recker RR, et al: Calcium intake and body weight. Journal of Clinical Endocrinology & Metabolism, Vol. 85, No. 12 (2000) 4635–4638
- Heaney RP, Davies KM, Barger-Lux MJ: Calcium and weight: clinical studies. Journal of the American College of Nutrition, Vol. 21, No. 2 (2002) 152S–155S
- Parikh SJ, Yanovski JA: Calcium intake and adiposity. American Journal of Clinical Nutrition, Vol. 77, No. 2 (2003) 281–287
- Pereira MA, Jacobs DR, Jr., Van Horn L, Slattery ML, Kartashov AI, Ludwig DS: Dairy consumption, obesity, and the insulin resistance syndrome in young adults: the CARDIA Study. Jama, Vol. 287, No. 16 (2002) 2081–2089
- Zemel MB, Shi H, Greer B, Dirienzo D, Zemel PC: Regulation of adiposity by dietary calcium. Faseb Journal, Vol. 14 (2000) 1132–1138
Wikimedia Foundation.
