- Ketoxime
-
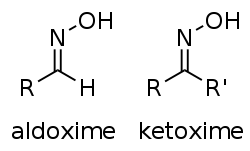
Oxime sind organische chemische Verbindungen, die als funktionelle Gruppe die Gruppierung C = N − OH enthalten. Je nach Art der beiden Reste am C-Atom unterscheidet man
- Aldoxime: einer der beiden Reste ist ein H-Atom: RHC = N − OH und
- Ketoxime: beide Reste (R1, R2) sind organische Reste: R1R2C = N − OH.
Nach IUPAC ist die Namensgebung auch durch Voranstellen von "Hydroxyimino" erlaubt.
Herstellung
Oxime kann man aus Hydroxylamin oder dessen Hydrochlorid und Carbonylverbindungen wie Aldehyden und Ketonen erhalten.
Verwendung
1,2-Dioxime werden als Chelat-Bildner eingesetzt. Mit Dimethylglyoxim lassen sich Nickel(II)-Ionen als wasserunlöslicher, leuchtend rosafarbener Komplex nachweisen.
Oxime werden als Antihautmittel (engl.: "anti-skinning agents") verwendet. Diese auch als Retarder oder Hautverhütungsmittel bezeichneten Stoffe verhindern die Hautbildung bei der Lagerung von Lacken. Verwendet werden hierzu meist flüchtige Oxime wie Acetonoxim oder Butanonoxim.
Des weiteren sind Oxime in der organischen Synthese interessant, da sie sich leicht zum Amin reduzieren, zum Nitril dehydratisieren oder zum Nitriloxid oxidieren lassen.
Bestimmte Oxime findet in der Medizin Anwendung bei der Therapie von Vergiftungen mit Thiophosphorsäureestern, wie z. B. mit dem Pflanzenschutzmittel E605. Die Giftwirkung dieser Thiophosphorsäureester beruht auf einer irreversiblen Hemmung (Phosphorylierung) des esteratischen Zentrums der Acetylcholinesterase und führt damit zunächst zu einer Acetylcholin-Überflutung des Körpers. Im Folgenden kommt es durch ständige Nervenimpulse zu Lähmungen und eventuell zum Tod durch Atemlähmung. Oxime wie Pralidoxim oder Obidoxim können in begrenztem Ausmaß die Acetylcholinesterase reaktivieren. Die Wirkung beruht auf einer Umphosphorylierung und Freigabe der Cholinesterase. Die Wirksamkeit hängt allerdings von der Kontaktdauer und den chemischen Eigenschaften des Giftstoffes ab. Die industriell wichtigste Verwendung von Oximen findet in der Beckmann-Umlagerung statt. Dabei wird das Oxim von Cyclohexanon in Gegenwart eines sauren Katalysators zu ε-Aminocaprolactam umgelagert, einem Zwischenprodukt für die Herstellung von Polyamiden.
Wikimedia Foundation.