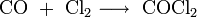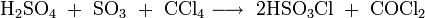- Kohlensäuredichlorid
-
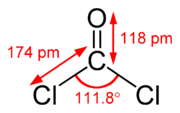
Strukturformel 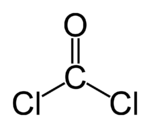
Allgemeines Name Phosgen Andere Namen - Carbonylchlorid
- Kohlensäuredichlorid
- Kohlenoxychlorid
Summenformel COCl2 CAS-Nummer 75-44-5 PubChem 6371 Kurzbeschreibung farbloses Gas[1] Eigenschaften Molare Masse 98,92 g·mol−1 Aggregatzustand gasförmig[1]
Dichte 4,531 kg·m−3 (Gasdichte 0 °C)[1]
1,4 g·cm−3 (flüssig am Siedepunkt)[1]Schmelzpunkt Siedepunkt 7,44 °C[1]
Dampfdruck Löslichkeit zersetzt sich in Wasser, gut löslich in organischen Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Sehr giftig (T+) R- und S-Sätze R: 26-34 S: 9-26-36/37/39-45 MAK 0,1 ml·m−3[1]
LD50 LC50(Mensch) ≈ 500 ppm·min-1[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phosgen ist der Trivialname für Kohlenoxiddichlorid oder Carbonylchlorid, COCl2, das Dichlorid der Kohlensäure. Formale Polymere werden demnach als Stoffgruppe der „Phosgene“ bezeichnet.
Inhaltsverzeichnis
Geschichte
Phosgen wurde 1812 von John Davy, dem jüngeren Bruder von Sir Humphry Davy, entdeckt. Der Name Phosgen (griech.: durch Licht erzeugt; vgl. biogen, anthropogen) stammt von der von ihm durchgeführten photoinduzierten Addition von Chlorgas auf Kohlenstoffmonoxid.
Der Einsatz von Phosgen als chemischer Gaskampfstoff (Grünkreuz) war für den Großteil der etwa 90.000[4] Gastoten des Ersten Weltkriegs verantwortlich.
Eigenschaften
Phosgen ist ein sehr giftiges Gas, dessen Geruch als süßlich faul (faulende Bananenschale oder feuchtes Heu) beschrieben werden kann. Dieser ist sehr charakteristisch und schnell zu identifizieren.
Phosgen ist gut in organischen Lösungsmitteln löslich (beispielsweise Benzol, Toluol, Chlorbenzolen und andere), es löst sich in Wasser unter allmählicher Zersetzung zu Kohlenstoffdioxid und Salzsäure, weshalb für die Synthese oder Umsetzung von Phosgen wasserfreie organische Lösungsmittel verwendet werden müssen.
Phosgen hat eine Verdampfungswärme von 24,38 kJ·mol−1.
Giftigkeit
Da Phosgen schlecht wasserlöslich ist, kann es beim Eindringen in die Lunge bis zur Blut-Luft-Schranke in den Lungenbläschen (Alveolen) gelangen. Geringe Dosen zersetzen sich in der Lunge mit der dort vorhandenen Feuchtigkeit allmählich zu Kohlenstoffdioxid und Salzsäure; die letztere verätzt das Lungengewebe und die Alveolen. Dies führt nach 2-3 Stunden zu quälendem Husten, Zyanose und Lungenödemen und endet meist tödlich. Der Tod tritt in der Regel bei vollem Bewusstsein ein. Hohe Dosen können auch binnen Sekunden oder Minuten zum Tod führen, indem die Phosgenmoleküle in hoher Anzahl mit den Aminosäuren der Alveolenwände reagieren und den Sauerstoffaustausch verhindern. Das in organischen Lösungsmitteln gelöste Phosgen beschleunigt und potenziert die giftige Wirkung. Anders als Senfgas wird Phosgen nur durch die Lunge aufgenommen, nicht durch die Haut.
Unfälle
- Am 20. Mai 1928 trat aus undichten Tanks auf dem Gelände der Hamburger Chemiefabrik Stolzenberg Phosgen aus. Es starben 10 Menschen, etwa 150 wurden verletzt.
- Am 14. März 2008 kam es in einem Labor der Technischen Universität München in Garching auf Grund eines technischen Defektes dazu, dass sich ein Schlauch von einer Versuchsanlage löste und Phosgen austrat. Zwei Personen wurden auf die Intensivstation gebracht, da sich Lungenödeme gebildet hatten, 38 weitere Personen wurden vorsorglich im Krankenhaus untersucht.[5]
Herstellung
Phosgen wird unter katalytischem Einfluss von Aktivkohle aus Kohlenmonoxid und Chlor hergestellt:
Die stark exotherme Reaktion muss mit großem Aufwand gekühlt werden, da Temperaturen im „Hotspot“ von bis zu 600°C entstehen. Kohlenmonoxid wird im Überschuss eingesetzt, um die vollständige Umsetzung des Chlors zu garantieren und somit einem Chloreisenbrand vorzubeugen. Restmengen von Methan die aus der Kohlenmonoxidherstellung stammen, reagieren zu Tetrachlorkohlenstoff. Das Kohlenmonoxid muss unbedingt frei von Wasserstoff sein, damit kein Chlorknallgas entsteht.
Phosgen kann durchaus auch bei der Verbrennung von chlorhaltigen Kunststoffen (beispielsweise PVC) in Gegenwart von Metall und Kohle entstehen. Im Labormaßstab kann es auch aus Tetrachlormethan und rauchender Schwefelsäure (Oleum) hergestellt werden:
Verwendung
Phosgen wurde als chemischer Gaskampfstoff militärisch eingesetzt.
Phosgen ist ein wichtiger Synthesebaustein beispielsweise zur Herstellung von Carbonsäurechloriden (wobei hier meist das unproblematischere Thionylchlorid verwendet wird) und Polyurethanen (über Isocyanate) sowie Polycarbonat-Kunststoffen (Abkürzung: PC, beispielsweise zur Herstellung von CDs) und anderen Zwischenprodukten, die dann zur Herstellung vom Medikamenten, Farbstoffen und Insektiziden dienen.
Wegen der Gefährlichkeit des Phosgens wird es heute in der chemischen Industrie zum überwiegenden Teil innerhalb derselben Anlage erzeugt, in der es auch verbraucht wird, sodass kein Transport stattfinden muss und das entstehende giftige Phosgen möglichst zügig und vollständig zu harmlosen Folgeprodukten umgesetzt wird. Als Alternative steht Diphosgen (Trichlormethoxyformylchlorid) und Triphosgen (Di-(Trichlormethoxy)-Formaldehyd) zur Verfügung, das zwar auch aus Phosgen hergestellt wird und dieselben präparativen Wirkungen zeigt, jedoch wesentlich ungefährlicher in der Anwendung und einfacher zu lagern ist.
Siehe auch
- Liste chemischer Kampfstoffe
- Lungenkampfstoff
- Rotkreuz (Nesselstoff)
- Diphosgen
- Triphosgen
- Thiophosgen
Referenzen
- ↑ a b c d e f g h Eintrag zu Phosgen in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 22. Februar 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 75-44-5 im European chemical Substances Information System ESIS
- ↑ HSDB
- ↑ Die Atomwaffe des kleinen Mannes - Spiegel Online
- ↑ Versuchpanne - Kampfgas strömt durch Münchner Uni - Spiegel Online
Literatur
- Beyer Hans, Walter Wolfgang: Lehrbuch der Organischen Chemie; S. Hirzel Verlag; Stuttgart - Leipzig 1998, 23. überarb. und aktualisierte Auflage; ISBN 3-7776-0808-4
Wikimedia Foundation.