- Lipidmembran
-
Biomembranen dienen als Trennschicht (Membranen) zwischen verschiedenen Bereichen innerhalb einer lebenden Zelle oder auch zwischen dem Inneren einer Zelle und dem Zellaußenraum (im Falle der Zellmembran). Innerhalb der Zelle trennen Biomembranen das Innere von Organellen oder Vakuolen vom Zytoplasma. Eine Biomembran ist jedoch nicht nur eine passive Trennschicht, sondern sie spielt eine aktive Rolle beim Transport von Molekülen und Informationen von einer Seite zur Anderen.
Inhaltsverzeichnis
Aufbau
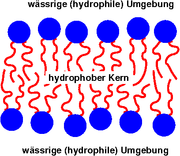
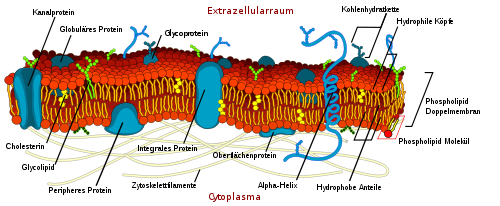
Biomembranen bestehen aus Lipiden und Proteinen. Der Lipidanteil bildet als Lipiddoppelschicht die Grundsubstanz der Membran und ist für ihre besonderen physikochemischen Eigenschaften verantwortlich. Insbesondere wirkt diese Doppelschicht als passive Trennschicht. Steroide wie das Cholesterin gehen eine hydrophobe Wechselwirkung mit den Lipiden ein und verfestigen die ansonsten flexible Biomembran. Darüber hinaus sind auf und innerhalb der Membran Proteine verteilt, welche die aktiven Funktionen der Membran übernehmen. Die Proteine haben nur eine sehr geringe Stützfunktion der Biomembran, da sie durch die Lipidschichten schwimmen.
Biomembranen können anhand ihrer Dichte charakterisiert werden; sie liegt meist zwischen 1,12 und 1,22 g·cm-3. Die Dichte ist vom Gewichtsverhältnis der Proteine zu den Lipiden abhängig: je nach Funktion der Membran werden Werte von 0,25 (Myelinmembran, geringer Proteinanteil), 1,3 (Plasmamembran von Erythrozyten), 2,5 (Plasmamembran von E. coli), 2,9 (Innere Mitochondrienmembran) bis hin zu einem Wert von 5 in der Purpurmembran bei Halobacterium (hoher Proteinanteil) gefunden.[1]
In bestimmten Arten von Zellorganellen (Zellkern, Mitochondrium, Plastid) treten Biomembranen als Doppelmembran auf.
Lipiddoppelschicht
Die Lipiddoppelschicht besteht größtenteils aus amphiphilen Phospholipiden, die eine hydrophile Kopfgruppe und eine hydrophobe Schwanzgruppe (meistens Kohlenwasserstoffketten) besitzen. In Wasser bildet sich eine Doppelschicht, bei der die hydrophoben Schwänze nach innen und die hydrophilen Köpfe nach außen zeigen. Wegen des hydrophoben Kerns ist eine solche Lipiddoppelschicht nahezu undurchlässig für Wasser und wasserlösliche Moleküle, gleichzeitig aber sehr flexibel und mechanisch schwer zu zerstören. Aus diesem Grund hinterlässt selbst ein Einstich mit einer Pipette kein Loch in der Membran. Dafür kann sie durch Lipidlösungsmittel und Lipasen zerstört werden.
Die Lipiddoppelschicht einer Biomembran ist normalerweise flüssig, d.h. die Lipide und Proteine sind in der Ebene der Membran recht beweglich. Ein Austausch von Lipiden zwischen den beiden Schichten oder gar ein Lösen eines Lipids von der Membran ist jedoch sehr selten. Eine gezielte Bewegung von einer Membranseite zur anderen (Flipflop) ist normalerweise nur unter dem aktiven Mitwirken von speziellen Proteinen (sog. Flipasen) unter Verbrauch von Adenosintriphosphat (ATP) möglich.
Wie flüssig die Lipiddoppelschicht ist, hängt vor allem von der Anzahl von ungesättigten Doppelbindungen in den hydrophoben Kohlenwasserstoffketten der Lipide ab. Je mehr, desto flüssiger ist die Membran. Andererseits wird der Grad der Flüssigkeit durch andere eingelagerte Moleküle bestimmt. Cholesterin zum Beispiel vermindert einerseits die Fluidität, verhindert aber bei niedrigen Temperaturen, dass sich die Membran gelartig verfestigt.
Vitamin E ist ein Antioxidans (wie Vitamin C), es schützt die ungesättigten Kohlenwasserstoffketten der Phospholipide der Biomembran vor der Zerstörung durch freie Radikale (Lipidperoxidation).
Membranproteine
Verschiedene Arten von Membranproteinen, die in die Lipiddoppelschicht eingelagert sind, sorgen für unterschiedliche Eigenschaften der Biomembranen.
Viele Proteine sind am Membrantransport beteiligt, d.h. am Stoffaustausch und der Signalübertragung über spezifische Rezeptoren. Gut untersucht ist eine Vielzahl von Membranproteinen, die unterschiedliche Zellarten und deren Reifestadien charakterisieren und sich von Individuum zu Individuum unterscheiden können (z.B. Blut- und Gewebegruppen). Dazu gehören auch Moleküle (meist Glykoproteine), die nach dem Schlüssel-Schloss-Prinzip zur Eigen-Fremd-Unterscheidung beitragen.
Nach dem Flüssig-Mosaik-Modell sind die Membranproteine nicht starr in der Membran fixiert, sondern zu hochdynamischen Ortsveränderungen innerhalb der Membran fähig. Diese Dynamik bildet die Voraussetzung für die Auslösung mannigfacher Signalketten auf Zellebene sowohl intrazellulär als auch zwischen kooperierenden Zellen.
Durchlässigkeit (Permeabilität)
Da die Biomembran vor allem eine Trennschicht zwischen verschiedenen Bereichen darstellt, ist sie für die meisten Moleküle undurchlässig. Kleinere lipophile Moleküle können frei durch die Lipiddoppelschicht der Membran diffundieren, wie z.B. Kohlendioxid, Alkohole und Harnstoff. Um die Durchlässigkeit der Membran für lipophobe Teilchen wie Wasser, oder große Teilchen wie Ionen oder Zuckermoleküle zu ermöglichen, sind in die Membran verschiedene Transportproteine eingelagert, die für den Transport bestimmter Stoffe zuständig sind. Deshalb spricht man von Semipermeabilität bzw. selektiver Permeabilität[2].
Funktion
Das Zytoplasma im Inneren einer Zelle wird durch eine Biomembran nach außen abgegrenzt. Diese nennt man Zellmembran, Plasmamembran, Plasmalemma oder Membrana cellularis.
Innerhalb der Zelle sorgen Biomembranen für eine Kompartimentierung der Zelle: Die meisten Zellen enthalten Reaktions- und Speicherräume (Kompartimente), wie z.B. die Zellorganellen und Vakuolen mit sehr unterschiedlichen chemischen Eigenschaften, die durch Biomembranen voneinander abgegrenzt sind.
Geschichte der Modell-Entwicklung
- 1895 Charles Overton nimmt an, dass die Biomembranen aus Lipiden bestehen. Dieses schloss er aus Beobachtungen, dass lipophile (fettlösliche) Substanzen, z.B. bestimmte Narkosemittel, sehr viel einfacher in Zellen gelangen können als solche Stoffe, die lipophob sind.
- 1917 Irving Langmuir vermutet, dass Phospholipide auf der Wasseroberfläche schwimmen.
- 1925 wurde von den niederländischen Wissenschaftlern Gorter und Grendel das Bilayer-Modell entwickelt[3]: Phospholipide mit hydrophilen Gruppen sind als Doppelschicht in der Membran so angeordnet, dass die hydrophilen Gruppen der Lipide jeweils nach außen zeigen, die hydrophoben in das Innere der Doppelschicht. Allerdings ließen die beiden Forscher mit ihrem Modell den großen Proteinanteil der Biomembran völlig außer Acht.
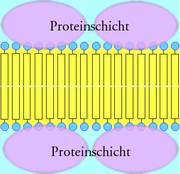
- 1935 stellten J. F. Danielli und H. Davson das klassische Modell des Aufbaus einer Biomembran vor: Die Biomembran besteht aus einer bimolekularen Lipidschicht. Die hydrophoben Schwänze der Lipide stehen sich gegenüber, die hydrophilen Köpfe sind von Proteinen überzogen. Kurz: Protein - Lipiddoppelschicht - Protein ("Sandwich"-Struktur). Elektronenmikroskopische Aufnahmen von Biomembranen lassen einen dreischichtigen Aufbau erkennen: zwei äußere Schichten (je 2,5 nm dick) und eine mittlere Schicht (3 nm dick).
- 1972 entwickelten Seymour Jonathan Singer und G. L. Nicolson das Flüssig-Mosaik-Modell ("fluid mosaic model") einer Biomembran[4] : Globuläre Proteinmoleküle "schwimmen" in einem bimolekularen Lipidfilm. Der Lipidfilm verhält sich wie eine zähe zweidimensionale Flüssigkeit, dadurch können Lipidmoleküle und Proteine ungehindert in der Membranebene diffundieren. Es gibt zwei Typen der Membranassoziation von Proteinen. Integrale Proteine, auch transmembrane Proteine genannt, reichen durch die Membran hindurch. Periphere Proteine, auch assoziierte Proteine genannt, sind der Lipid-Doppelschicht aufgelagert.
- 1972 Zeitgleich mit Singer und Nicolson schlossen Frye und Edidin aus Versuchen mit zwei Zellen, bei denen bestimmte Membranproteine markiert wurden, dass die Membran nicht statisch sein kann, sondern in ständiger Bewegung ist. Sie vereinigten die markierten Zellen und die erst getrennt vorliegenden markierten Bereiche der Membran vermischten sich.
- Seit der Aufstellung des Flüssig-Mosaik Modells von Singer und Nicholson 1972 wurden zahlreiche Hinweise entdeckt, die zur Formulierung des dynamisch strukturierte Mosaikmodelles[5] führten. Verschiedene Untersuchungen zeigten, dass die Proteine und verschiedenen Lipidmoleküle keineswegs gleichmäßig auf der Oberfläche der Membran verteilt sind, wie es in einer reinen Flüssigkeit zu erwarten wäre. Stattdessen scheint es Gebiete mit einer hohen Konzentration von bestimmten Proteinen (sogenannte Rezeptor-Inseln) oder bestimmten Lipidtypen zu geben (sogenannte rafts), die sich ständig umgruppieren, auflösen und wieder zusammenfinden.
Einzelnachweise
- ↑ Hans Kleinig, Uwe Maier, Kleinig/Sitte Zellbiologie. Verlag Gustav Fischer, 1999. ISBN 3-437-26010-3
- ↑ Biomembrane I: Selective Permeability of Membranes
- ↑ Gorter, E. & Grendel, F. (1925): On bimolecular layers of lipoids on the chromocytes of the blood. The Journal of Experimental Medicine. Bd. 41, S. 439-443.
- ↑ Singer, S.J. & Nicolson, G.L. (1972): The fluid mosaic model of the structure of cell membranes. Science. Bd. 175, S. 720-731. PMID 4333397.
- ↑ Vereb, G. et al. (2003): Dynamic, yet structured: The cell membrane three decades after the Singer-Nicolson model. Proc. Natl. Acad. Sci. USA. Bd. 100, S. 8053-8058. PMID 12832616 PDF
Weblinks
- Biomembranen / Plasmamembran und Glykokalix / Flüssig-Mosaik-Modell Grafik
- Phillip Eichman, « From the lipid bilayer to the fluid mosaic: a brief history of membrane models », University of Minnesota: Sociology, History and Philosophy of Science: teachers' network news, Vol. 9 (2), 1999.
Wikimedia Foundation.