- 3,4-Lutidin
-
Die Lutidine oder Dimethylpyridine bilden eine Gruppe von aromatischen Verbindungen mit zwei Methylgruppen am Pyridin. Durch deren unterschiedliche Anordnung ergeben sich sechs Konstitutionsisomere. Das 2,6-Lutidin ist das bekannteste Isomer.
Inhaltsverzeichnis
Eigenschaften
Die Lutidine sind farblose bis gelbe Flüssigkeiten mit einem charakteristischen Geruch und leicht öliger Konsistenz. Sie sind mit Wasser und Alkoholen mischbar. Die Siedepunkte zeigen zumeist keine großen Unterschiede. Sie sind gesundheitsschädlich, zwei Isomere sind giftig.
Lutidine Name 2,3-Lutidin 2,4-Lutidin 2,5-Lutidin 2,6-Lutidin 3,4-Lutidin 3,5-Lutidin Andere Namen 2,3-Dimethyl-
pyridin2,4-Dimethyl-
pyridin2,5-Dimethyl-
pyridin2,6-Dimethyl-
pyridin3,4-Dimethyl-
pyridin3,5-Dimethyl-
pyridinStrukturformel 

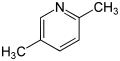



CAS-Nummer 583-61-9 108-47-4 589-93-5 108-48-5 583-58-4 591-22-0 PubChem 11420 7936 11526 7937 11417 11565 Summenformel C7H9N Molare Masse 107,16 g·mol−1 Aggregatzustand flüssig Kurzbeschreibung farblose bis gelbe Flüssigkeiten mit charakteristischem Geruch und leicht öliger Konsistenz Schmelzpunkt −15 °C[1] −60 °C[2] −15 °C[3] −6 °C[4] −6 °C[5] −9 °C[6] Siedepunkt 162–163 °C[1] 159 °C[2] 157 °C[3] 144 °C[4] 163–164 °C[5] 169–170 °C[6] pKs-Wert[7]
(der konjugierten Säure BH+)6,57 6,77 6,40 6,60 6,46 Löslichkeit 95 g·l−1[1] 350 g·l−1[2] löslich[4] 33 g·l−1[5] 33 g·l−1[6] Gefahrstoff-
kennzeichnung
[1][2][3][4][5][6]
Gesundheits-
schädlich(Xn) 
Giftig (T) 
Gesundheits-
schädlich(Xn) 
Gesundheits-
schädlich(Xn) 
Giftig (T) 
Gesundheits-
schädlich(Xn) R-Sätze 10-20/21/22 10-25 10-20/21/22-36/37/38 10-22 10-22-24 10-20/21/22-36/37/38-41 S-Sätze 16-36/37 24/25-37-45 16-26-36/37/39-45 23-26 36/37-45 16-26-36 2,6-Lutidin
Das 2,6-Lutidin wurde aus Steinkohlenteer[8] und Knochenöl isoliert.[9] Es besitzt einen charakteristischen nussartigen Geruch. In der organischen Synthese dient das 2,6-Lutidin als sterisch gehinderte milde Base. Die Darstellung erfolgt analog der Hantzschen Dihydropyridinsynthese aus Acetessigsäureethylester (als β-Ketocarbonylverbindung), Formaldehyd und Ammoniak im Verhältnis 2:1:1 in Gegenwart von etwas Diethylamin.[10]
Siehe auch
Einzelnachweise
- ↑ a b c d Eintrag zu CAS-Nr. 583-61-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. März 2009 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 108-47-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. März 2009 (JavaScript erforderlich).
- ↑ a b c Eintrag zu CAS-Nr. 589-93-5 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. März 2009 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 108-48-5 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. März 2009 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 583-58-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. März 2009 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu CAS-Nr. 591-22-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. März 2009 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ G. Lunge, J. Rosenberg: "Ueber die Lutidine des Steinkohlentheers", in: Berichte der deutschen chemischen Gesellschaft 1887, 20 (1), 127–137; doi:10.1002/cber.18870200132.
- ↑ Merck Index, 11th Edition, 5485.
- ↑ 2,6-Dimethylpyridin, Versuchsvorschrift aus: Organic Syntheses, Coll. Vol. 2, p. 214 (1943); Vol. 14, p. 30 (1934).
Wikimedia Foundation.
