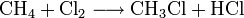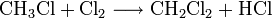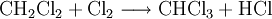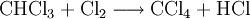- Methenylchlorür
-
Strukturformel 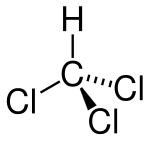
Allgemeines Name Chloroform Andere Namen - Trichlormethan (IUPAC)
- Chloretherid
- Methenylchlorür
- Methinchlorid
Summenformel CHCl3 CAS-Nummer 67-66-3 PubChem 6212 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 119,38 g·mol−1 Aggregatzustand flüssig
Dichte 1,48 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 61 °C[1]
Dampfdruck Löslichkeit gut in Alkohol, Ether, Benzol, 0,82% in Wasser (20 °C)
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-38-40-48/20/22 S: (2)-36/37 MAK 0,5 ml/m3[1]
WGK 3 – stark wassergefährdend[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Chloroform (systematische Bezeichnung Trichlormethan) ist ein chlorierter Kohlenwasserstoff mit der Summenformel CHCl3.
Inhaltsverzeichnis
Geschichte
Chloroform wurde im Jahre 1831 unabhängig voneinander von Justus von Liebig und Eugene Souberain hergestellt. Nachdem seine narkotisierende Wirkung schon im Jahre 1847 durch den französischen Physiologen Marie Jean Pierre Flourens und den englischen Geburtshelfer James Young Simpson erkannt worden war, war es das Verdienst des Letzteren, Chloroform ein Jahr darauf in die ärztliche Praxis einzuführen und unzähligen Patienten Operationsschmerzen zu ersparen. Aufgrund der damaligen Operationsverfahren hatte die Verwendung dieses Narkotikums große Bedeutung für die ganze chirurgische Tätigkeit. Unter anderem fürchteten die Kranken schon lange vor einer Operation die bevorstehenden Schmerzen und kamen dann vielfach bereits moralisch geschwächt auf den Operationstisch. Dort wurden sie nach bestimmten für jede besondere Operation vorgezeichneten Methoden geknebelt, damit sie während der schmerzhaften Prozedur nicht etwa durch störende Bewegungen Hindernisse bereiteten. Bei dem Eingriff selbst war das erste und wesentlichste Erfordernis die Schnelligkeit, der oft die Exaktheit, Sauberkeit und Gründlichkeit zum Opfer gebracht worden waren. Mittels Chloroform wurden nicht nur die schwersten und eingreifendsten Operationen schmerzfrei durchgeführt, es konnte auch viel genauer gearbeitet werden.
Gewinnung und Darstellung
Industrielles Chloroform wird durch Erhitzen von Chlor mit Methan oder Chlormethan auf 400–500 °C erzeugt. Bei dieser Temperatur wird schrittweise radikalisch substituiert bis hin zum Tetrachlormethan:
Dabei reagiert Methan mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, dann weiter zu Dichlormethan, Trichlormethan und schließlich zu Tetrachlormethan. Das Ergebnis des Prozesses ist eine Mischung der vier Chlormethane, welche durch Destillation getrennt werden können. Industriell hergestelltes Chloroform technischer Reinheit enthält zudem Brom- und Ethanderivate (z.B. Bromchlormethan, Bromdichlormethan, 1,2-Dichlorethan) als Verunreinigung[3] sowie Ethanol (< 1 %) oder Pentene (< 0,1 %) die als Stabilisator künstlich zugefügt werden, um das beim Lagern an Luft und Licht entstehende Phosgen abzufangen[4].
Verwendung
Chloroform wird in erster Linie als Lösungsmittel und zur Herstellung von Fluorchlorkohlenwasserstoffen (FCKW) verwendet.
In der chemischen Synthese wird es zur Herstellung von Dichlorcarben (in Gegenwart von Basen) verwendet. Durch Friedel-Crafts-Reaktion mit Benzol erhält man Triphenylmethan.
Deuteriertes Chloroform (CDCl3), auch Deuterochloroform genannt, findet in der Kernresonanzspektroskopie (NMR) als meistgebrauchtes Lösungsmittel Verwendung.
Eigenschaften
Trichlormethan ist eine farblose, nicht entflammbare, flüchtige Flüssigkeit von süßlichem Geruch. Der Schmelzpunkt liegt bei −63 °C, der Siedepunkt bei 61 °C. Es hat eine größere Dichte als Wasser und ist nur wenig darin löslich. Die Dämpfe verursachen Bewusstlosigkeit und heben die Schmerzempfindung auf. Wegen der toxischen Wirkung auf Herz, Leber und andere innere Organe wird Chloroform heute aber nicht mehr als Narkosemittel angewendet. Es steht außerdem unter Verdacht, krebserregend zu sein. Chloroform wird durch Sauerstoff unter Lichteinfluss photochemisch zersetzt, dabei entsteht Phosgen, Chlor und Chlorwasserstoff. Handelsübliches Chloroform enthält 0,5–1,0 % Ethanol als Stabilisator.
Rechtsbestimmungen
Da Chloroform im Anhang IV der Verordnung (EWG) Nr. 2377/90 über Höchstmengen für Tierarzneimittelrückstände in Nahrungsmitteln aufgeführt ist, ist seine Anwendung bei lebensmittelliefernden Tieren in der Europäischen Union generell verboten.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Chloroform in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8. Dezember 2007 (JavaScript erforderlich).
- ↑ Eintrag zu CAS-Nr. 67-66-3 im European chemical Substances Information System ESIS
- ↑ Schadstofflexikon.
- ↑ Sigma-Aldrich: Chloroform.
Weblinks
Wikimedia Foundation.

-3.jpg)