- Methylenchlorid
-
Strukturformel 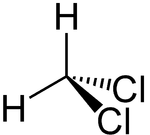
Allgemeines Name Dichlormethan Andere Namen - Methylenchlorid
- Methylendichlorid
Summenformel CH2Cl2 CAS-Nummer 75-09-2 PubChem 6344 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 84,93 g·mol−1 Aggregatzustand flüssig
Dichte 1,33 g·cm−3 (20 ºC)[1]
Schmelzpunkt Siedepunkt 39,7 °C[2]
Dampfdruck Löslichkeit schwer löslich in Wasser (20 g·l−1 bei 20 ºC[1]), gut in organischen Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 40 S: 23-24/25-36/37 GWP 8,7 (bezogen auf 100 Jahre) [4] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dichlormethan (Methylenchlorid) ist ein chlorierter Kohlenwasserstoff.
Inhaltsverzeichnis
Eigenschaften
Methylenchlorid, CH2Cl2, (Dichlormethan, DCM) ist eine farblose, nur schwer brennbare Flüssigkeit mit einem Schmelzpunkt von −95 °C und einem Siedepunkt von 39,8 °C. Es riecht süßlich, ähnlich dem Chloroform. Es hat eine höhere Dichte als Wasser und löst sich zu 20 g/l darin. Seine Brechzahl nD20 ist 1,4242.
Die Verdampfungsenthalpie beträgt 28,82 kJ/mol [5].
Bei Aufnahme von flüssigem Dichlormethan (auch über die Haut) treten Vergiftungserscheinungen auf wie Kopfschmerzen, Schwindel, Appetitlosigkeit, bis hin zu narkoseähnlichen Zuständen. Bei der Verbrennung von Dichlormethan entsteht gasförmiges Phosgen, welches hochgiftig ist. Es besteht der Verdacht auf krebserzeugende Wirkung. In Wasser gelöst schädigt es Kleinorganismen wie Daphnien.
Gewinnung
Großtechnisch wird Dichlormethan in einer radikalischen Substitution durch direkte Reaktion von Methan und Chlor oder Chlormethan bei einer Temperatur von 400–500 °C hergestellt. Bei dieser Temperatur findet eine schrittweise radikalische Substitution bis hin zu Tetrachlormethan statt:
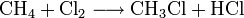
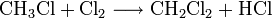
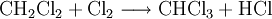
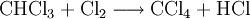
- Methan reagiert mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, und weiter zu Dichlormethan, Trichlormethan und schließlich Tetrachlormethan.
Das Ergebnis des Prozesses ist eine Mischung der vier Chlormethane, welche durch Destillation getrennt werden können.
Dichlormethan kann durch Rückflusskochen über Phosphorpentoxid (oder Phosphorpentoxid-haltigen Trocknungsmitteln) und anschließende Destillation getrocknet werden. Die Aufbewahrung von getrocknetem Dichlormethan erfolgt über Molekularsieb 3Å.
Verwendung
Methylenchlorid dient als Abbeizmittel für Lacke, Entfettungsmittel und Extraktionsmittel für Koffein sowie als Lösungsmittel für Harze, Fette, Kunststoffe und Bitumen. Außerdem wird es als Kältemittel in Kühlaggregaten eingesetzt.
Beim Herstellen von Polyurethanschäumen ersetzt es das ungiftige, aber ozonabbauende Frigen R141.
In der laborchemischen Synthese ist es eines der gängigsten Lösungsmittel bei Reaktionen und Extraktionen und wird oft als Ersatz für das teurere und bereits an Luft und Licht zu Phosgenbildung neigende Chloroform genommen.
Im Modellbau (z.B. Architektur) wird es häufig als Klebstoff eingesetzt aufgrund seiner Fähigkeit Acrylglas transparent und schnell zu verbinden ohne die Finger zu verkleben. Aber auch für Polystyrol kommt es im Modellbau zur Anwendung.
In der Industrie wird Methylenchlorid auch häufig dazu verwendet Kunststoffe zu kleben. Dazu gehören eine Vielzahl thermoplastischer Kunststoffe. Dichlormethan löst den Kunststoff an und "verschweißt" so den Kunststoff nahtlos. Folgende Kunststoffe eignen sich zum Kleben mit Methylenchlorid: Polystyrol, Acrylglas, Polycarbonat, PET-G und ABS. Polypropylen und Polyethylen lassen sich nicht kleben, weil diese nicht löslich sind.
Sicherheitshinweise
Beim Umgang mit Dichlormethan sollte Schutzkleidung einschließlich Handschuhen getragen werden. Latex- oder Nitrilhandschuhe sind nicht ausreichend. Stattdessen sollten Handschuhe aus Viton oder Butyl verwendet werden. Die Lagerung dieser Verbindung sollte in einem Temperaturbereich zwischen +15 bis +25 °C erfolgen.
Dichlormethan darf keinesfalls mit metallischem Natrium oder anderen Alkalimetallen in Kontakt kommen, weil dies zu Explosionen führen kann [1].
Die Dämpfe sind schwerer als Luft. Man sollte Raumluftabsaugung in Bodenhöhe vorsehen und unter Abzug oder Absaugung arbeiten und die Dämpfe nicht einatmen.
Quellen
- ↑ a b c d Eintrag zu Dichlormethan in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 9.12.2007 (JavaScript erforderlich)
- ↑ Rippen, G.: Handbuch der Umweltchemikalien; ecomed-Verlagsgesellschaft Loseblattsammlung, Stand: 1991; Landsberg/Lech, 1991
- ↑ Eintrag zu CAS-Nr. 75-09-2 im European chemical Substances Information System ESIS
- ↑ P. Forster, P., V. Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 213, (PDF)
- ↑ Lide, D.R. (Editor-in Chief): CRC Handbook of Chemistry and Physics, 73rd edition; Boca Raton (1992)
Wikimedia Foundation.
