- Monostiban
-
Strukturformel 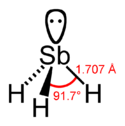
Allgemeines Name Stiban Andere Namen - Antimonhydrid
- Antimontrihydrid
- Antimonwasserstoff
- Monostiban
- Stibin
Summenformel SbH3 CAS-Nummer 7803-52-3 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 124,77 g·mol−1 Aggregatzustand gasförmig
Dichte 2,158 g·cm−3 (flüssig, −17 °C)[1]
Schmelzpunkt Siedepunkt −17 °C[1]
Dampfdruck Löslichkeit wenig löslich in Wasser, besser in Alkohol und Kohlenstoffdisulfid
Dipolmoment 0,4·10−30 C·m [3] Sicherheitshinweise Gefahrstoffkennzeichnung }[1] 

Sehr giftig Hoch-
entzündlich(T+) (F+) R- und S-Sätze R: 12-26 S: (1)-9-16-33-36-45 Thermodynamische Eigenschaften ΔHf0 145 kJ/mol [3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Stiban (Monostiban oder Antimonwasserstoff, veraltet auch als Stibin bezeichnet), chemische Formel SbH3, ist ein farbloses, übelriechendes und äußerst giftiges Gas, das bei der Auflösung von salzartigen Antimoniden in Wasser und verdünnten Säuren entsteht.
Inhaltsverzeichnis
Gewinnung und Darstellung
Stiban wird aus löslichen Antimonverbindungen und naszierendem Wasserstoff gewonnen. So entsteht bei der Reaktion von Antimon(III)-hydroxid mit naszierendem Wasserstoff Stiban und Wasser.
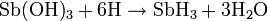
Eine andere Möglichkeit besteht darin, Magnesiumantimonid in einem Überschuss verdünnter Salzsäure zu lösen.
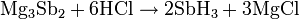
Beide Methoden bringen jedoch den Nachteil mit sich, dass das entstehende Gas hauptsächlich aus Wasserstoff besteht. Durch abkühlen des Gases auf unter −17 °C kann dieser jedoch abgetrennt werden, da Stiban bei dieser Temperatur kondensiert.
Eine Methode, die diesen Nachteil nicht mit sich bringt, ist die Hydrierung von Antimon(III)-chlorid mittels Natriumborhydrid in salzsaurer Lösung.
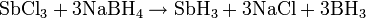
Eigenschaften
Physikalische Eigenschaften
Der Schmelzpunkt liegt bei −88 °C, der Siedepunkt bei −17 °C. Die Gibbs-Energie
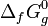 beträgt 148 kJ/mol, die Standardentropie
beträgt 148 kJ/mol, die Standardentropie 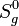 233 J/(mol·K) und die Wärmekapazität
233 J/(mol·K) und die Wärmekapazität 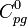 41 J/(mol·K).[3] Stiban ist ein pyramidales Molekül mit den drei Wasserstoff-Atomen an der dreieckigen Pyramidenbasis und dem Antimon-Atom an der Pyramidenspitze. Die Winkel H-Sb-H betragen 91.7°, der Abstand Sb-H beträgt 1.707 Å.
41 J/(mol·K).[3] Stiban ist ein pyramidales Molekül mit den drei Wasserstoff-Atomen an der dreieckigen Pyramidenbasis und dem Antimon-Atom an der Pyramidenspitze. Die Winkel H-Sb-H betragen 91.7°, der Abstand Sb-H beträgt 1.707 Å.Chemische Eigenschaften
Die chemischen Eigenschaften des Stibans ähneln dem Arsenwasserstoff. Typisch für ein Schwermetallhydrid ist Stiban instabiler als die jeweiligen Elemente. Bei Raumtemperatur zerfällt das Gas langsam, bei 200 °C jedoch sehr schnell. Dieser Prozess verläuft autokatalytisch und unter Umständen explosiv.
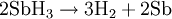
Mit starken Brønsted-Basen lässt sich Stiban unter Bildung von Antimoniden deprotonieren.
Verwendung
Stiban wird in der Halbleiterindustrie zur n-Dotierung von Silicium verwendet.
Sicherheitshinweise
Aufgrund der hohen Toxizität und der leichten Entflammbarkeit ist beim Umgang mit Stiban Vorsicht geboten. Es sollte mit Schutzkleidung und Schutzmaske, fernab von offenen Flammen und Funkenbildung gehandhabt werden.
Einatmen von Stiban kann zu Husten, Übelkeit, Hals- und Kopfschmerzen, Mattigkeit, blutigem Urin und zu Atemnot führen. Es können Schädigungen des Blutes, der Leber, der Nieren und des Zentralnervensystems auftreten, die zum Tod führen können.
Aufgrund der Instabilität sollte Stiban wenn möglich nicht gelagert werden.
Nachweis
Stiban lässt sich mit der Marsh'schen Probe nachweisen. Hierzu wird Stiban, vermischt mit Wasserstoff, durch ein dünnes, zu einer Spitze ausgezogenem Glasrohr, geleitet und am Ende abgefackelt. Dabei wird das Glasrohr mit einem Bunsenbrenner erhitzt, wobei sich Anwesenheit von Stiban im Glasrohr ein Antimonspiegel bildet. Der Antimonspiegel unterscheidet sich von einem Arsenspiegel durch seine dunklere Farbe, außerdem ist er in Natriumhypochloritlösung unlöslich und färbt sich mit Polysulfidlösung orange.
Literatur
- A.F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin/New York 1995. ISBN 3-11-012641-9.
- G. Jander, E. Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 15. Auflage. S. Hirzel Verlag, Stuttgart/Leipzig 2002. ISBN 3-7776-1146-8.
- Autorenteam: RÖMPP CD 2006. Georg Thieme Verlag, Stuttgart/New York 2006. ISBN 3-131-43321-3.
Quellen
- ↑ a b c d Eintrag zu Stiban in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 14.9.2007 (JavaScript erforderlich)
- ↑ Berka L., Briggs T., Millard M., Jolly W. (1960): J. Inorg. Nucl. Chem.. 14, S. 190–194
- ↑ a b c G.H. Aylward, T.J.V. Findlay: Datensammlung Chemie in SI-Einheiten. 3. Auflage. Wiley-VCH, 1999, ISBN 3-527-29468-6.
Wikimedia Foundation.
