- Antimon
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Antimon, Sb, 51 Serie Halbmetalle Gruppe, Periode, Block 15, 5, p Aussehen silbrig glänzend grau CAS-Nummer 7440-36-0 Massenanteil an der Erdhülle 0,65 ppm[1] Atomar [2] Atommasse 121,750 u Atomradius (berechnet) 145 (133) pm Kovalenter Radius 139 pm Van-der-Waals-Radius 206[3] pm Elektronenkonfiguration [Kr] 4d10 5s2 5p3 1. Ionisierungsenergie 834 kJ/mol 2. Ionisierungsenergie 1594,9 kJ/mol 3. Ionisierungsenergie 2440 kJ/mol 4. Ionisierungsenergie 4260 kJ/mol 5. Ionisierungsenergie 5400 kJ/mol Physikalisch [2] Aggregatzustand fest Kristallstruktur trigonal Dichte 6,697 g/cm3 Mohshärte 3,0 Magnetismus diamagnetisch (χm = −6,8 · 10−5)[4] Schmelzpunkt 903,78 K (630,63 °C) Siedepunkt 1860 K (1587 °C) Molares Volumen 18,19 · 10−6 m3/mol Verdampfungswärme 68 kJ/mol Schmelzwärme 19,7 kJ/mol Elektrische Leitfähigkeit 2,5 · 106 A/(V · m) Wärmeleitfähigkeit 24 W/(m · K) Chemisch [2] Oxidationszustände −3, 3, 5 Normalpotential 0,150 V (Sb3+ + 3 e− → Sb) Elektronegativität 2,05 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE (MeV) ZP 119Sb 38,19 h ε 0,594 119Sn 120Sb 5,76 d ε 2,681 120Sn 121Sb 57,36 %
Stabil 122Sb 2,7238 d β− 1,979 122Te ε 1,620 122Sn 123Sb 42,64 %
Stabil 124Sb 60,20 d β− 2,905 124Te 125Sb 2,7582 a β− 0,767 125Te Weitere Isotope siehe Liste der Isotope Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [5] 
Achtung
H- und P-Sätze H: 335 EUH: keine EUH-Sätze P: 262 [5] Gefahrstoffkennzeichnung [6] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Antimon [antiˈmoːn] (von lat. Antimonium, vermutlich von arabisch ithmid / إثمد / iṯmid; Symbol von lateinisch Stibium „(Grau-)Spießglanz“) ist ein chemisches Element mit dem Elementsymbol Sb und der Ordnungszahl 51. Im Periodensystem steht es in der 5. Periode und der 5. Hauptgruppe (Gruppe 15) oder Stickstoffgruppe. In der stabilen Modifikation ist es ein silberglänzendes und sprödes Halbmetall.
Inhaltsverzeichnis
Geschichte
Als Typlokalität für gediegen Antimon gilt zwar die Silbermine in der schwedischen Gemeinde Sala im Västmanland,[7] allerdings war metallisches Antimon schon den Chinesen und Babyloniern bekannt und einige seiner Verbindungen wurden schon in der Bronzezeit als Zuschlag zu Kupfer verwendet, um Bronze herzustellen (Funde von Velem-St. Vid in Ungarn). Im 17. Jahrhundert ging der Name Antimon als Bezeichnung auf das Metall über. Die koptische Bezeichnung für das Schminkpuder Antimonsulfid ging über das Griechische in das Lateinische stibium über. Die von Jöns Jakob Berzelius benutzte Abkürzung Sb wird noch heute als Elementsymbol genutzt. Ganz sicher ist diese Herleitung nicht. Es gibt auch andere Vermutungen über die Herkunft der Elementbezeichnung. Der ungewöhnliche Name gehe auf das spätgriechische anthemon (deutsch: „Blüte“) zurück. Damit sollen die stengelartigen Kristalle, die büschelförmig angeordnet sind und wie eine Blüte aussehen, beschrieben werden.
Vorkommen
Antimon ist ein selten vorkommendes Element und, da es in der Natur auch gediegen, das heißt in elementarer Form gefunden werden kann, von der International Mineralogical Association (IMA) unter der System-Nr. 1.CA.05[8] als Mineral anerkannt.
Weltweit konnte gediegen Antimon bisher (Stand: 2011) an rund 300 Fundorten nachgewiesen werden, so unter anderem in mehreren Regionen von Australien; in den bolivianischen Departements La Paz und Potosí; Minas Gerais in Brasilien; Schwarzwald, Fichtelgebirge, Oberpfälzer Wald, Odenwald und im Harz in Deutschland; Seinäjoki in Finnland; mehreren Regionen von Frankreich; Lombardei, Piemont, Sardinien und Trentino-Südtirol in Italien; einigen Regionen von Kanada; einigen Regionen von Österreich; Ost- und Westsibirien und Ural in Russland; neben Västmanland noch Dalarna, Gästrikland, Närke, Södermanland, Värmland und Västerbotten in Schweden; in einigen Regionen der Slowakei; Böhmen und Mähren in Tschechien sowie in vielen Regionen der USA.[9]
Bisher sind 264 Antimon-Minerale bekannt (Stand: 2010).[10] Industriell genutzt wird überwiegend das Sulfid-Mineral Stibnit Sb2S3 mit einem Gehalt von max. 71,7 % Sb. Das Mineral mit dem höchsten Sb-Gehalt in einer Verbindung ist die natürliche Antimon-Arsen-Legierung Paradocrasit (max. 92 %), allerdings kommt sie mit nur drei Fundorten[11] im Gegensatz zum Stibnit (rund 2500 Fundorte)[12] sehr viel seltener vor.
Gewinnung und Darstellung
Technisch wird Antimon aus dem Antimonglanz gewonnen. Ein Verfahren beruht auf dem Abrösten und der Reduktion mit Kohlenstoff (Röstreduktionsverfahren):
Eine andere Möglichkeit besteht darin, die Reduktion mit Eisen durchzuführen (Niederschlagsverfahren):
Weltweit wurden zu Beginn des 21. Jahrhunderts zwischen 110.000 und 160.000 Tonnen pro Jahr an Antimon gefördert. Seit 1900 hat sich damit die Fördermenge mehr als verzehnfacht.
Eigenschaften
Kristallographische Daten[13] 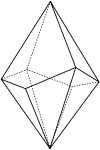
Idealisierte Kristallform eines ditrigonalen Skalenoeders.
Kristallsystem trigonal - ditrigonal-skalenoedrisch Raumgruppe 
Gitterparameter
(Elementarzelle)a = 431 pm; c = 1127 pm Zahl (Z) der Formeleinheiten Z = 6 Modifikationen
Antimon kann in drei verschiedenen Modifikationen auftreten, wobei metallisches bzw. graues Antimon die beständigste Modifikation ist.
Durch Abschrecken von Antimondampf an kalten Flächen entsteht amorphes, schwarzes und sehr reaktives Antimon, welches sich durch Erhitzen wieder in metallisches Antimon umwandelt. Durch elektrolytische Herstellung entsteht explosives Antimon, dass beim Ritzen explosionsartig aufglühend und funkensprühend in metallisches Antimon übergeht. Gelbes Antimon ist dagegen keine eigenständige Modifikation, sondern eine hochpolymere chemische Verbindung mit Wasserstoff.[14]
Unter Normalbedingungen kristallisiert Antimon trigonal in rhomboedrischer Aufstellung in der nach der Hermann-Mauguin-Symbolik beschriebenen Raumgruppe
 mit den Gitterparametern a = 431 pm und c = 1127 pm sowie sechs Formeleinheiten pro Elementarzelle.
mit den Gitterparametern a = 431 pm und c = 1127 pm sowie sechs Formeleinheiten pro Elementarzelle.Physikalische Eigenschaften
Metallisches Antimon ist silberweiß, stark glänzend, blättrig-grobkristallin. Es lässt sich aufgrund seiner Sprödigkeit leicht zerkleinern. Die elektrische und thermische Leitfähigkeit ist gering. Flüssiges Antimon expandiert als einer von wenigen Stoffen beim Erstarren (Dichteanomalie). Zum Siedepunkt existieren in der Literatur mit 1325 °C, 1587 °C, 1635 °C und 1750 °C unterschiedliche Angaben.
Chemische Eigenschaften
Mit naszierendem Wasserstoff reagiert Antimon zum instabilen Antimonhydrid SbH3. Von Luft und Wasser wird Antimon bei Raumtemperatur nicht angegriffen. Oberhalb des Schmelzpunktes verbrennt es in Luft mit bläulich-weißer Flamme zu Antimon(III)-oxid. In heißen konzentrierten Mineralsäuren löst es sich auf. Mit den Halogenen reagiert es schon bei Raumtemperatur heftig zu den entsprechenden Halogeniden.
In Verbindungen liegt Antimon überwiegend in den Oxidationsstufen +3 und +5 vor. In Metallantimoniden wie Kaliumantimonid K3Sb bildet es Sb3−-Ionen.
Isotope
Es existieren zwei stabile Antimon-Isotope: 121Sb und 123Sb.
Verwendung
Der überwiegende Teil des hergestellten Antimons wird zu Legierungen verarbeitet und zeigt dabei folgende Eigenschaften:
- Es dient zur Härtung von Blei- und Zinnlegierungen.
- Im Gegensatz zu allen anderen Metallen dehnt es sich beim Abkühlen der Schmelze aus (infolge Umwandlung in eine andere Modifikation): Der Antimongehalt kann so eingestellt werden, dass solche Legierungen beim Abkühlen nicht schrumpfen oder sich sogar etwas ausdehnen; bei in Gießformen hergestellten Teilen presst sich das Metall dadurch beim Erstarren in alle Ecken und Winkel, so dass auch komplizierte Formen und stark gemusterte Oberflächen lunkerfrei hergestellt werden können.
Wichtige Legierungen:
- Blei-Antimon-Legierungen: Hartblei, Letternmetall, Lagermetall, Akkumulatoren-Blei, Bleimantel für Erdkabel
- Zinn-Antimon-Legierungen: Britanniametall, Lagermetall
- Herstellung von Halbleitern
- Zinn-Antimon-Kupferlegierungen (Babbit-Metall) für Lagermetalle
- Zinn-Antimon-Kupfer-Bleilegierungen für Zinngeschirr und andere Gebrauchsartikel aus Zinn
- so genanntes Lötzinn oder Weichlot
- Aluminium-Antimon, Gallium-Antimon, Indium-Antimon für IR- und Halleffektgeräte
- Schrumpffreie Antimon-Legierungen für Präzisionsguss
Weitere Anwendungen:
- Herstellung von Antimonverbindungen
- Im Mittelalter auch als Arzneimittel, zum Beispiel Brechweinstein (Kaliumantimonyltartrat)
- Bestandteil von Sprengstoffzündern
- Antimontrisulfid in Bremsbelägen von Fahrzeugen.
- Antimon(V)-sulfid
- zur Herstellung (Vulkanisieren) von rotem Kautschuk (Beispiel: Labor-Gummischläuche)
- als roter Bestandteil des Zündkopfes in Streichhölzern
- früher als Augenschminken und in der Augenheilkunde, als „Augenerweiterer“
- Antimonchromat als gelbes Farbpigment
- Antimonoxide
- Katalysator zur Herstellung von Polyester und PET (Antimon(III)-oxid)
- als Weißpigment zur Färbung von Polystyrol, Polyethylen und Polypropylen
- Herstellung weißer Glasuren und Fritten
- Läuterung von Bleiglas
- mit Zinn dotiert als transparent-leitfähige Beschichtung („ATO“ Antimon-Tin-Oxide), beispielsweise auf Gläsern zur Herstellung von Displays oder in elektrisch leitfähigen Pigmenten („Minatec“) für Fußbodenbeläge zur Ableitung elektrostatischer Aufladungen.
- in Pigmenten („Lazerflair“) für die LASER-Markierung von Kunststoffteilen, wegen der starken Absorption von Infrarot-Strahlung üblicher Markierungslaser (Nd-YAG).
- in Tarnanstrichen wegen der starken Infrarot-Absorption.
- als Flammschutzmittel als Bestandteil von flammfesten und flammhemmenden Farben, Kunststoffen und Textilien für Kabelumhüllungen, Autositzbezüge, Vorhangstoffe, Kinderbekleidung u. ä.
- Antimonsalze als Bestandteil von Pestiziden, Beizen und Feuerwerksartikeln
- Scheidemittel für Gold. Antimon fällt Silber aus Goldschmelzen aus.
Medizinische Bedeutung
Antimonpräparate finden Anwendung als Medikation bei einer Chemotherapie gegen Leishmaniose.[15]
Sicherheitshinweise und Grenzwerte
Von den Antimonverbindungen sind seitens der EU Antimonfluorid als giftig (T) und die Chloride als ätzend (C) eingestuft, außerdem als umweltgefährlich (N); alle anderen Antimonverbindungen als gesundheitsschädlich (Xn) und umweltgefährlich (N)[16]. Antimon selbst ist dort nicht aufgeführt, laut Sicherheitsdatenblatt ist es als reizend gekennzeichnet.
Die Internationale Agentur für Krebsforschung (IARC) stuft Antimon(III)-oxid als möglicherweise krebserzeugende Substanz ein.[17]
Ergebnisse aus Untersuchungen deuten darauf hin, dass Antimonverbindungen Haut und Schleimhäute reizen. Diese Verbindungen lösen sich vermutlich aus Kunststoff und Textilien.
In der EU gilt für Trinkwasser ein Grenzwert von 5 µg/l. Untersuchungen von in PET-Flaschen abgefüllten Fruchtsäften (für die keine Richtlinien existieren) ergaben Antimonkonzentrationen bis zu 44,7 µg/l in unverdünnten Saftkonzentraten.[18][19]
Nachweis
Vorproben:
Flammenfärbung. Flamme fahlblau, wenig charakteristische Phosphorsalzperle: Farblos (gestört durch alle Elemente, die eine farbige Perle erzeugen)
Reduktion durch unedle Metalle, wie zum Beispiel Eisen, Zink oder Zinn.
In nicht zu sauren Lösungen reduzieren unedle Metalle Antimon-Kationen Sb(III), Sb(V) und Sb(III)/(V) zu metallischem Antimon:
- 2 Sb3+ + 3 Fe → 2 Sb + 3 Fe2+
Die auf Antimon zu prüfende Substanz wird in salzsaure Lösung gegeben und mit Eisenpulver versetzt. Es entsteht ein schwarzer flockiger Niederschlag aus metallischem Antimon in der Lösung oder direkt am Eisen. Auch der Nachweis an einem Eisennagel ist möglich. Dabei ist eine schwarze Ablagerung am Nagel ein Nachweis für Antimon, welches sich hier elementar niedergeschlagen hat.
Die Marshsche Probe gestattet einen eindeutigen Nachweis von Antimon. Wenn die pyrolytisch abgeschiedene Substanz (dunkel glänzender Spiegel) sich nicht in ammoniakalischem Wasserstoffperoxid löst, sind Arsen und Germanium als mögliche Alternativen ausgeschlossen.
Die hochempfindliche Bestimmung winziger Antimonspuren erfolgt durch die Hydridtechnik der Atomspektrometrie. Hierbei wird im Prinzip die Marshsche Probe mit der Atomabsorptionsspektrometrie gekoppelt. Die Matrixeffekte der Probelösung lassen sich dadurch sehr wirksam unterdrücken.
Verbindungen
- Antimonwasserstoff, auch Monostiban SbH3 genannt.
Giftiges Gas, das sich aus Antimon und einwirkenden Säuren bildet. - Distiban (Sb2H4)
Halogenverbindungen
- Antimon(V)-fluorid (SbF5) bildet (nach VSEPR) eine quadratische Pyramide aus und hybridisiert dabei zu sp3d
- Antimonpentachlorid (SbCl5)
- Antimon(III)-fluorid (SbF3)
- Antimontrichlorid (SbCl3)
- Antimontribromid (SbBr3)
- Antimontriiodid (SbI3)
Sauerstoffverbindungen
- Antimon(III)-oxid (Antimontrioxid) (Sb2O3)
- Antimon(III,V)-oxid (Antimontetroxid) (Sb2O4)
- Antimon(V)-oxid (Antimonpentaoxid, (Sb2O5)
- antimonige Säure/Antimontrihydroxid (H3SbO3/Sb(OH)3)
- Antimonsäure (HSb(OH)6)
Schwefelverbindungen
- Antimontrisulfid, auch Antimonglanz genannt (Sb2S3)
Grauschwarze, metallisch glänzende Stängel. Ausgangsstoff zur Herstellung metallischen Antimons. Löslich in starken Säuren. Verwendung für Streichhölzer, Rubingläser und Tarnanstriche (Reflexion von IR-Licht). - Antimonpentasulfid, früher als Goldschwefel bezeichnet (Sb2S5)
Sonstige Verbindungen
- Antimon(V)-chloridfluorid (SbCl4F) (Katalysator für die Herstellung von Polytetrafluorethylen („Teflon“))
- Aluminiumantimonid (AlSb)
- Galliumantimonid (GaSb)
- Indiumantimonid (InSb)
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Antimon) entnommen.
- ↑ Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 2009, 113, S. 5806–5812, doi:10.1021/jp8111556.
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics: A ready-reference book of chemical and physical data, 90. Aufl., CRC Taylor & Francis, Boca Raton Fla. 2009, ISBN 978-1-4200-9084-0, Section 4, S. 4-142 bis 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Eintrag zu CAS-Nr. 7440-36-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. März 2011 (JavaScript erforderlich).
- ↑ Datenblatt Antimonpulver bei AlfaAesar, abgerufen am 2. Februar 2010 (JavaScript erforderlich).
- ↑ Mindat – Sala Silver Mine, Sala, Västmanland, Sweden
- ↑ IMA/CNMNC List of Mineral names – Antimony (englisch, PDF 1,8 MB; S. 14)
- ↑ Mindat – Localities for Antimony (englisch)
- ↑ Webmineral - Mineral Species sorted by the element Sb (Antimony)
- ↑ Mindat – Paradocrasite
- ↑ Mindat – Stibnite
- ↑ Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 50.
- ↑ Lautenschläger u.a.: Taschenbuch der Chemie. 15.5 Antimon und Antimonverbindungen; Verlag Harri Deutsch, Frankfurt am Main 2001
- ↑ Rüdiger Dörris: Medizinische Mikrobiologie. Thieme Georg Verlag, ISBN 3-13-125313-4, S. 527.
- ↑ RL 67/548/EWG, Anhang 1
- ↑ Bundesamt für Gesundheit Schweiz (BAG): Risikoanalyse: Antimon in Lebensmitteln und Fertiggerichten, die direkt in PET-Schalen zubereitet werden. (PDF) 23. August 2007.
- ↑ Claus Hansen, Alexandra Tsirigotaki, Søren Alex Bak, Spiros A. Pergantis, Stefan Stürup, Bente Gammelgaard and Helle Rüsz Hansen: Elevated antimony concentrations in commercial juices. Journal of Environmental Monitoring, 17. Februar 2010, abgerufen am 1. März 2010.
- ↑ Sophie Borland: Fruit juice cancer warning as scientists find harmful chemical in 16 drinks. Daily Mail, 1. März 2010, abgerufen am 1. März 2010.
Weblinks
 Wiktionary: Antimon – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Antimon – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen Commons: Antimon – Album mit Bildern und/oder Videos und Audiodateien
Commons: Antimon – Album mit Bildern und/oder Videos und Audiodateien Wikibooks: Praktikum Anorganische Chemie/ Antimon – Lern- und Lehrmaterialien
Wikibooks: Praktikum Anorganische Chemie/ Antimon – Lern- und Lehrmaterialien- EnvironmentalChemistry.com - Antimony
- Elementymology & Elements Multidict: Antimony (by Peter van der Krogt)
- „Nachrichten aus der Chemie“ „Antimon: das vergessene Gift?“ von Michael Krachler, Universität Heidelberg
- Mineralienatlas:Antimon (Wiki)
- Chemie im Alltag: Mozart – Opfer einer Antimonvergiftung?
Kategorien:- Reizender Stoff
- Gruppe-15-Element
- Halbmetall
- Periode-5-Element
- Chemisches Element
- Mineral
- Trigonales Kristallsystem
- Elemente (Mineralklasse)
Wikimedia Foundation.








