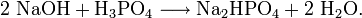- Na2HPO4
-
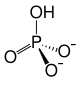
Strukturformel 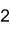
Allgemeines Name Dinatriumhydrogenphosphat Andere Namen - Natriumhydrogenphosphat
- di-Natriumphosphat
Summenformel Na2HPO4 CAS-Nummer 7558-79-4 (wasserfrei)
10028-24-7 (Dihydrat)
7782-85-6 (Heptahydrat)
10039-32-4 (Dodecahydrat)PubChem 24203 Kurzbeschreibung farblose, kristalline Substanz[1] Eigenschaften Molare Masse 141,96 g·mol−1 (wasserfrei)
178,01 g/mol (Dihydrat)
268,07 g·mol−1 (Heptahydrat)
358,14 g·mol−1 (Dodecahydrat)Aggregatzustand fest
Dichte Schmelzpunkt >250 °C (Zersetzung, wasserfrei)[1]
93 °C (Dihydrat)[1]
48 °C (Heptahydrat)[1]
35 °C (Dodecahydrat)[1]Siedepunkt nicht zutreffend
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 17000 mg/kg (Ratte, oral)[2]
WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dinatriumhydrogenphosphat ist ein Natriumsalz der Phosphorsäure. Es wird auch als sekundäres Natriumphosphat bezeichnet.
Inhaltsverzeichnis
Eigenschaften
Wasserfreies Dinatriumhydrogenphosphat stellt sich als farblose, kristalline, hygroskopische Verbindung dar. Neben der wasserfreien Verbindung sind auch drei Hydrate bekannt:[1]
- Dihydrat (Na2HPO4 · 2 H2O)
- Heptahydrat (Na2HPO4 · 7 H2O)
- Dodecahydrat (Na2HPO4 · 12 H2O)
Ein Mol wasserfreies Dinatriumhydrogenphosphat nimmt aus der Luft 2 Mol Wasser auf und bindet es als Kristallwasser. Die höheren Hydrate verwittern an Luft zum Dihydrat.[3] Beim Erhitzen wird zunächst alles Kristallwasser abgegeben (Dodecahydrat bei 35 Grad C°, Heptahydrat bei 48 Grad C° und Dihydrat bei 92,5 Grad C°)[1], anschließend (bei ca. 250 °C) aber auch – aus je zwei Molekülen – ein weiteres Wassermolekül, wodurch ein Pyrophosphat entsteht.[4]
Synthese
Im Labor kann Natriumhydrogenphosphat aus Natronlauge und Phosphorsäure hergestellt werden.
Verwendung
Dinatriumhydrogenphosphat findet in der Molekularbiologie und Biochemie zur Herstellung von Pufferlösungen Anwendung. Man kann durch Mischen von Dinatriumhydrogenphosphat- mit Natriumdihydrogenphosphat-Lösung einen Puffer mit bestimmten pH-Wert herstellen oder man kann auch durch zupipettieren von konzentrierter Natronlauge zu einem Phosphat-Puffer den pH-Wert einstellen. Weiterhin ist es Bestandteil von manchen Laxantien.
Quellen
- ↑ a b c d e f g h i j Eintrag zu CAS-Nr. 7558-79-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20.01.2008 (JavaScript erforderlich)
- ↑ a b Sicherheitsdatenblatt Carl Roth
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 774.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 337–338.
Wikimedia Foundation.