- Dinatriumhydrogenphosphat
-
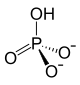
Strukturformel 
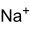
Allgemeines Name Dinatriumhydrogenphosphat Andere Namen - Natriumhydrogenphosphat
- di-Natriumphosphat
- Dinatriumhydrogenorthophosphat
Summenformel Na2HPO4 CAS-Nummer 7558-79-4 (wasserfrei)
10028-24-7 (Dihydrat)
7782-85-6 (Heptahydrat)
10039-32-4 (Dodecahydrat)PubChem 24203 Kurzbeschreibung farblose, kristalline Substanz[1]
Eigenschaften Molare Masse 141,96 g·mol−1 (wasserfrei)
178,01 g/mol (Dihydrat)
268,07 g·mol−1 (Heptahydrat)
358,14 g·mol−1 (Dodecahydrat)Aggregatzustand fest
Dichte Schmelzpunkt >250 °C (Zersetzung, wasserfrei)[1]
93 °C (Kristallwasserabspaltung, Dihydrat)[1]
48 °C (Kristallwasserabspaltung, Heptahydrat)[1]
35 °C (Kristallwasserabspaltung, Dodecahydrat)[1]Löslichkeit Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 17.000 mg·kg−1 (Ratte, oral)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dinatriumhydrogenphosphat ist ein Natriumsalz der Phosphorsäure. Es wird auch als sekundäres Natriumphosphat bezeichnet.
Inhaltsverzeichnis
Eigenschaften
Wasserfreies Dinatriumhydrogenphosphat ist eine farblose, kristalline, hygroskopische Verbindung. Neben der wasserfreien Verbindung sind auch drei Hydrate bekannt:[1]
- Dihydrat (Na2HPO4 · 2 H2O)
- Heptahydrat (Na2HPO4 · 7 H2O)
- Dodecahydrat (Na2HPO4 · 12 H2O)
Ein Mol wasserfreies Dinatriumhydrogenphosphat nimmt aus der Luft 2 Mol Wasser auf und bindet es als Kristallwasser. Die höheren Hydrate hingegen verwittern an Luft zum Dihydrat.[3] Diese Stabilität des Dihydrats ist auch der Grund für seine Wahl als Puffersubstanz. Beim Erhitzen wird zunächst alles Kristallwasser abgegeben (Dodecahydrat bei 35 °C, Heptahydrat bei 48 °C und Dihydrat bei 92,5 °C)[1], anschließend (bei ca. 250 °C) aber auch – aus je zwei Molekülen – ein weiteres Wassermolekül, wodurch ein Pyrophosphat entsteht.[4]
Synthese
Im Labor kann Natriumhydrogenphosphat aus Natronlauge und Phosphorsäure hergestellt werden.
Verwendung
Dinatriumhydrogenphosphat findet in der Molekularbiologie und Biochemie zur Herstellung von Pufferlösungen Anwendung. Man kann durch Mischen von Dinatriumhydrogenphosphat- mit Natriumdihydrogenphosphat-Lösung einen Puffer mit bestimmten pH-Wert zwischen 5 und 8 herstellen. Weiterhin ist es Bestandteil von manchen Arzneimitteln als pH-Puffer.
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 7558-79-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2008 (JavaScript erforderlich).
- ↑ a b Datenblatt Dinatriumhydrogenphosphat bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 774.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-7776-0672-9, S. 337–338.
Wikimedia Foundation.


