- NaCN
-
Strukturformel 

Allgemeines Name Natriumcyanid Andere Namen - Natriumzyanid
- Cyannatrium
- Blausaures Natron
- Blausaures Natrium
Summenformel NaCN CAS-Nummer 143-33-9 Kurzbeschreibung farbloses, kristallines Pulver mit schwach bittermandelartigem Geruch [1] Eigenschaften Molare Masse 49,01 g·mol−1 Aggregatzustand fest
Dichte 1,60 g·cm−3 [1]
Schmelzpunkt Siedepunkt 1500 °C [1]
Dampfdruck Löslichkeit gut löslich in Wasser: 580 g·l−1 in Wasser (20 °C) [1], schlecht löslich in organischen Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 26/27/28-32-50/53 S: (1/2)-7-28-29-45-60-61 MAK 3,8 mg·m−3 [1]
LD50 WGK 3 – stark wassergefährdend [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumcyanid ist das Natriumsalz der Blausäure (HCN). Bei Raumtemperatur liegt es als farbloses, hygroskopisches kristallines Pulver vor, das leicht bittermandelartig riecht.
Inhaltsverzeichnis
Darstellung
Natriumcyanid wird durch Neutralisation von Blausäure mit Natronlauge nach dem Andrussow-Verfahren gewonnen. Ausgangsstoffe für die Synthese sind Methan, Ammoniak und Sauerstoff.
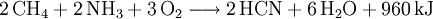
- Methan, Ammoniak und Sauerstoff reagieren bei 1546 °C und Anwesenheit von Platin bzw. Rhodium-Katalysatoren zu Blausäure und Wasser.
Die nachfolgende Neutralisation ergibt Natriumcyanid.
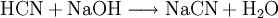
- Blausäure und Natronlauge ergeben Natriumcyanid und Wasser.
Früher wurde Natriumcyanid nach dem Castner-Verfahren durch Reaktion von Natrium mit Kohle und Ammoniak gewonnen.[4]
Eigenschaften
Natriumcyanid ist sehr giftig. Wenn es in größeren Mengen in die Umwelt gelangt, ist es eine starke Belastung für das Ökosystem. Natriumcyanid zersetzt sich im Gegensatz zu Kaliumcyanid leicht in warmer wässriger Lösung, dabei entsteht Natriumformiat und Ammoniak.
Verwendung
Natriumcyanid wird zusammen mit Kaliumcyanid zur Gewinnung von Gold, Silber und anderen Metallen (Cyanidlaugerei) verwendet.[5]
In der Galvanotechnik wird es für verschiedene Cyanidische Bäder genutzt[6], so zum Beispiel cyanidische Kupfer-, Messing-, Bronze-, Zink-, Cadmium- und Goldbäder.
Bei der Metallbearbeitung kommt geschmolzenes Natriumcyanid zum Härten bestimmter Stahlsorten (Einsatzstähle) zum Einsatz.[7]
Die Organische Chemie nutzt Natriumcyanid zur Synthese von Nitrilen.
Sicherheitshinweise
Es ist darauf zu achten, dass Natriumcyanidstaub und -dämpfe nicht eingeatmet werden. Behälter müssen dicht geschlossen sein sowie kühl und trocken gelagert werden.
Entgiftung
Da Natriumcyanid auf Lebewesen stark toxisch wirkt, darf es auf keinen Fall über das Abwasser in die Umwelt gelangen, sondern muss in einer Abwasserbehandlungsanlage vollständig oxidiert werden. Dies geschieht auf folgende Weise:
1. Durch Behandlung mit Natriumhypochlorit (NaClO) nach folgender Gleichung:
Das Behandeln mit Natriumhypochlorit hat den Nachteil, dass der AOX-Wert des Abwassers stark ansteigt.
2. Durch Zugabe von Wasserstoffperoxid (H2O2).
3. Durch Behandlung mit Ozon (O3) und UV-Licht.
4. Durch Oxidation an Kohle- oder Platinanoden mit Hilfe von Gleichstrom.
Ziel der Entgiftung ist eine vollständige Zerlegung des Natriumcyanids in Kohlendioxid und Stickstoff.
Nachweis
Nachweis von Cyanid-Ionen:
Zu einer alkalischen Cyanidlösung wird im Unterschuss Eisen(II)-sulfat-Lösung zugegeben. Sind Cyanidionen vorhanden, dann bildet sich nach dem Ansäuern und Zugabe von Eisen(III)-chlorid-Lösung (Vorsicht: HCN-Bildung!) Berliner Blau.[8]
Quellen
- ↑ a b c d e f g h i Eintrag zu Natriumbromid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 22.05.2007 (JavaScript erforderlich)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Blausäuresalze“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2009 (JavaScript erforderlich)
- ↑ a b Sicherheitsdatenblatt Merck
- ↑ A. F. Holleman, N. Wiberg: Lehrbuch der Anorganischen Chemie, 101. Auflage, S. 1339, de Gruyter, Berlin 2007, ISBN 3-110-12641-9.
- ↑ Erwin Riedel: Anorganische Chemie. 5. Auflage, S. 731–732, de Gruyter, Berlin 2002, ISBN 3-11-017439-1.
- ↑ C. F. Burgess, L. F. Richardson: Die Verwendung von Cyankalium für galvanische Bäder, in: Angew. Chem. 1914, 27, 211–212; doi:10.1002/ange.19140273002.
- ↑ Natriumcyanid auf enius.de
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum, S. 356–357, 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9
Wikimedia Foundation.

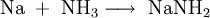
![\mathrm{\xrightarrow [-H_2] {+C}\ \ Na_2CN_2\ \xrightarrow [-H_2] {+C}\ \ NaCN}](/pictures/dewiki/101/e854f6609312b0a9fbbe7cee9fb43302.png)