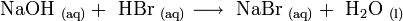- NaBr
-
Kristallstruktur 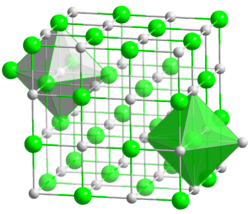
__ Na+ __ Br- Kristallsystem kubisch Raumgruppe 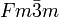
Koordinationszahlen Na[6], Br[6] Allgemeines Name Natriumbromid Verhältnisformel NaBr CAS-Nummer 7647-15-6 Kurzbeschreibung farblose Kristalle[1] Eigenschaften Molare Masse 102,89 g·mol–1 Aggregatzustand fest
Dichte 3,20 g/cm3 (20 °C)[2]
Schmelzpunkt 755 °C[2]
Siedepunkt 1393 °C[2]
Dampfdruck Löslichkeit 905 g/l (20 °C) in Wasser[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze LD50 3500 mg/kg (Ratte, oral)[1]
WGK 1[2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumbromid ist das Natriumsalz des Bromwasserstoffs. Es ist ein farbloser Feststoff mit der Formel NaBr.
Inhaltsverzeichnis
Eigenschaften
Natriumbromid kristallisiert in der Natriumchlorid-Struktur.[3] Die wässrige Lösung reagiert schwach sauer. So besitzt eine Lösung von 50 g Natriumbromid pro Liter Wasser bei 20 °C einen pH-Wert von 5,4.[1]
Darstellung
Natriumbromid kann durch Reaktion von Natriumhydroxid und Bromwasserstoff hergestellt werden:
Verwendung
Natriumbromid kann zur Herstellung elementaren Broms im Labormaßstab dienen. Hierzu wird Chlorgas in eine wässrige Lösung von Natriumbromid geleitet. Diese Reaktion kann allgemein zum Nachweis löslicher Bromide herangezogen werden.[4]
Aus Natriumbromid kann im Labormaßstab Bromwasserstoff hergestellt werden. Hierzu wird konzentrierte Phosphorsäure bei schwach erhöhter Temperatur auf den Feststoff getropft.
Es können hierzu auch andere Säuren, zum Beispiel Schwefelsäure, verwendet werden, doch ist hierbei die Reaktion oft zu wenig kontrollierbar, um einen konstanten Gasstrom zu erzeugen.
Quellen
- ↑ a b c d Sicherheitsdatenblatt Merck
- ↑ a b c d e f Eintrag zu Natriumbromid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18.12.2007 (JavaScript erforderlich)
- ↑ A. F. Holleman, N. Wiberg: Lehrbuch der Anorganischen Chemie, 101. Auflage, S. 1170, de Gruyter, Berlin 2007, ISBN 3-110-12641-9.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum, S. 281, 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9
Wikimedia Foundation.