- Nachweisreaktionen
-
Ein Nachweis ist eine Methode der Analytischen Chemie, die dazu dient, eine Stoffprobe (den Analyten) qualitativ zu untersuchen. Davon zu unterscheiden sind quantitative Bestimmungsmethoden und Methoden der Strukturanalytik.
Die Nachweisreaktion ist eine chemische Reaktion, die das Vorhandensein eines Analyten anzeigt. Das Bild rechts zeigt beispielsweise eine Niederschlagsbildung im Reagenzglas als Nachweisreaktion für Chlorid-Anionen mit Hilfe von Silbersalzlösung und Ammoniakwasser.
Mit dem Nachweis (der Nachweisreaktion) kann eine Probe ohne oder mit relativ einfachen apparativen Mitteln untersucht werden auf:
- in ihr enthaltene Einzelkomponenten (qualitativ),
- deren ungefähre Menge oder Konzentration (halbquantitativ) sowie
- auf strukturelle Besonderheiten, z. B. funktionelle Gruppen
- Spezies, in denen ein Element vorliegt (z. B. Chlor als Chlorid oder Hypochlorit oder elementar)
So werden chemische Elemente, eventuell vorhandener Ionen und funktionelle Gruppen mit Hilfe vieler „Schnelltests“ (Teststreifen oder nasschemische Nachweisreaktionen) in der Probe identifiziert. Von zentraler Bedeutung ist dabei neben diversen Messmethoden vor allem die Sinneswahrnehmung, während zur Konzentrationsanalytik und Strukturanalytik (in Forschung, Produktion (Analytik) und Chemieunterricht) Methoden der instrumentellen Analytik eingesetzt werden. Hierzu zählen z. B. instrumentelle Bestimmungsmethoden der Chromatographie, Spektrometrie, Photometrie, Osmometrie, Refraktometrie, Volumetrie, Gravimetrie und elektroanalytische Methoden.
Inhaltsverzeichnis
Methodologie
Die Methoden umfassen Fällungsreaktionen, Redoxreaktionen, Verdrängungsreaktionen, Komplexbildungsreaktionen und Flammproben. Gegebenenfalls ist die Probe vor Durchführung der Nachweisreaktion aufzubereiten oder von störenden Begleitstoffen zu reinigen.
In der anorganisch-analytischen Chemie geschieht das qualitative Nachweisen von Stoffen in Stoffproben z. B. in Form der Durchführung des Kationentrennganges (vgl. unter Qualitative Analyse und im folgenden Artikelabschnitt).
Anwendungsgebiete und Geschichte
Quantitative Bestimmungen von Stoffen werden oft mit ähnlichen Nachweisreaktionen durchgeführt, zielen aber darauf ab, Gehaltsangaben für die zuvor qualitativ nachgewiesenen Stoffe zu ermitteln (vgl. unter: Quantitative Nachweise). Diese kommen oft nur in Spuren vor (<1 %), knapp oberhalb der Grenzkonzentration (GK) oder der Erfassungsgrenze (EG) der Nachweisreaktion, so dass physikalische Analysemethoden eingesetzt werden müssen (Gaschromatografie, Atomabsorptionsspektroskopie usw.). So lassen sich heutzutage auch Spurenstoffe im ppb-Bereich erfassen (1 ppb = 1:109; siehe unter: Quantitative Analyse, Instrumentelle Analytik, Analytische Chemie).
Qualitative sowie quantitative Nachweise auch von nur in Spuren vorhandenen Stoffen durchführen zu können, war früher von großer Bedeutung in der Chemie. Das Beispiel des Arsens zeigt diese Bedeutung im Hinblick auf die Kriminalistik: Die Marshsche Probe ist eine Nachweisreaktion in der Chemie und Gerichtsmedizin für Arsen, die 1832 von dem englischen Chemiker James Marsh entwickelt wurde. Vor der Entdeckung der Marsh'schen Probe war Arsen ein beliebtes Mordgift, da es sich nur schwer nachweisen ließ. Ein anderer Arsennachweis ist die Bettendorfsche Probe (über Zinn(II)-chlorid).
Durch die Instrumentelle Analytik und ihre Methoden wie z. B. die spektroskopischen Verfahren hat die Bedeutung von Nachweisreaktionen in der Analytik abgenommen. Für die Vermittlung fachspezifischer Inhalten und Methoden sind sie jedoch nach wie vor von didaktischer Bedeutung (vgl. unter: Chemieunterricht).
Nachweisreaktion
Die Nachweisreaktion ist also vor allem eine Voruntersuchung zur quantitativen Bestimmung oder zur Strukturaufklärung. Sie hat in der Regel die Funktion eines Schnelltests, der gewisse Hinweise zur Proben-Beschaffenheit liefert.
Nachweise von Ionen
Einige Salze sind nur sehr schlecht wasserlöslich. Dies nutzt man zum Nachweis von Ionen. Dazu mischt man eine wässrige Lösung der Untersuchungssubstanz mit einer Vergleichslösung. Die in der Probe enthaltenen Ionen reagieren mit den Ionen der Vergleichslösung und fallen als schwer wasserlösliches Salz aus.
Nachweise von Gasen
Nachweisreaktionen existieren z. B. für Gase, Anionen und Kationen (Letztere hier mit jeweiligem Reaktionsschema und in etwaiger Reihenfolge des Kationentrenngangs):
Wasserstoff
Für den Nachweis von Wasserstoff eignet sich die Knallgasprobe. Das unbekannte Gas wird entzündet. Vernimmt man hierbei einen Knall oder ein lautes Pfeifen, handelte es sich um Wasserstoff:
Sauerstoff
Sauerstoff weist man mit der Glimmspanprobe nach. Ein glimmender Holzspan glüht in einem Gasgemisch mit hohem Sauerstoff Anteil deutlich auf.
Kohlenstoffdioxid
Für den Nachweis von Kohlenstoffdioxid verwendet man eine Calciumhydroxidlösung. Dazu leitet man das Gas in gesättigtes Kalkwasser und ein weißer Feststoff (Calciumcarbonat) fällt aus.
Ammoniak
Für den Nachweis von Ammoniak verwendet man gasförmigen Chlorwasserstoff bzw. konzentrierte Salzsäure. Dabei entsteht Ammoniumchlorid, der als weißer Nebel ausfällt.
Nachweise für Säuren und Basen
Ein Säure-Base-Indikator ist ein Stoff, der durch eine Farbveränderung pH-Wert-Änderungen durch Säuren oder Basen anzeigt. Am häufigsten werden Säure-Base-Indikatoren daher bei Titrationen verwendet (siehe unter Säure-Base-Titration).
Säuren und Basen enthalten in wässriger Lösung Oxonium- bzw. Hydroxidionen. Diese lassen sich beispielsweise mit Universalindikator nachweisen. Hierbei ändert der Indikator abhängig vom pH-Wert der Probesubstanz seine Farbe. Andere Säure-Base-Indikatoren sind zum Beispiel Phenolphthalein und Bromthymolblau.
Nachweis von Wasser
Wasser entsteht zum Beispiel als Kondensat gasförmigen Wasserdampfes oder als Reaktionsprodukt aus der Neutralisation von Säuren und Laugen. Man weist es mit wasserfreiem Kupfer(II)-sulfat nach: wasserfreies, weißes Kupfersulfat färbt sich bei Zugabe von Wasser hellblau. Es entsteht ein Kupfertetraqua-Komplex, bei dem vier Wassermoleküle als Liganden des Zentralions auftreten:
Dabei handelt es sich um eine Komplexbildungsreaktion.
Ein weiterer sehr empfindlicher Wassernachweis auf der Grundlage von Komplexbildung ist die Rosafärbung von blauem (also wasserfreiem) Cobaltchlorid, dies wird zur Herstellung von Wasserteststreifen aus blauem Cobaltchloridpapier genutzt.
Weitere Nachweisverfahren
Literatur
- Gerhart Jander, E. Blasius: Einführung in das anorganisch-chemische Praktikum. S. Hirzel Verlag, Stuttgart 2005 (in 15. Aufl.), ISBN 3-7776-1364-9
- Gerhart Jander, E. Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. S. Hirzel Verlag, Stuttgart 2002 (in 15. Aufl.), ISBN 3-7776-1146-8
- Michael Wächter: Stoffe, Teilchen, Reaktionen. Verlag Handwerk und Technik,Hamburg 2000, S.154-169 ISBN 3-582-01235-2
- Bertram Schmidkonz: Praktikum Anorganische Analyse. Verlag Harri Deutsch, Frankfurt 2002, ISBN 3-8171-1671-3
- Dr. Thomas Bitter (Redaktion): elemente Chemie I - Unterrichtswerk für Gymnasium. Ernst Klett Schulbuchverlag GmbH, Stuttgart 1986 (1. Aufl.), ISBN 3-12-759400-3
Weblinks
Wikimedia Foundation.


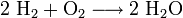
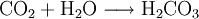
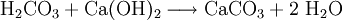
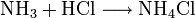

![\mathrm{CuSO_4 + 4 \ H_2O \longrightarrow [Cu(H_2O)_4]^{2+} \ SO_4^{2-}}](/pictures/dewiki/52/42bf9c0304bbba57a509f0a5309d4e5c.png)