- Grundlagen der Chemie
-
Die Chemie ist die Lehre vom Aufbau, Verhalten und der Umwandlung der chemischen Elemente und ihren Verbindungen sowie den dabei geltenden Gesetzmäßigkeiten.
Bei chemischen Reaktionen werden Bindungen zwischen Atomen getrennt und neu gebildet, es findet also eine Stoffumwandlung statt. Da die für die Chemie relevanten Eigenschaften der Atome fast ausschließlich in ihrer elektronischen Struktur (Elektronenhülle) begründet liegen, können grundlegende Aufgabengebiete der Chemie auch als „Physik der äußeren Elektronenhülle“ betrachtet werden.
Alle Vorgänge, bei denen mindestens ein neuer Stoff entsteht, gehören mithin in den Bereich der Chemie. Alle Eingriffe, die die Zusammensetzung des Stoffes (Stoff = Substanz) hinsichtlich der Elemente, aus denen er besteht unverändert lassen (z. B.: Schmelzen, Erstarren), gehören hingegen zur Physik. Zur Kernphysik zählen Veränderungen am Atomkern.
Inhaltsverzeichnis
Atome
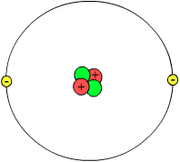 Schematische Darstellung eines Helium-Atoms: Zwei Elektronen umkreisen einen Kern aus zwei Protonen und zwei Neutronen
Schematische Darstellung eines Helium-Atoms: Zwei Elektronen umkreisen einen Kern aus zwei Protonen und zwei NeutronenEin Atom besteht aus dem Kern mit Protonen und Neutronen sowie der Elektronenhülle. Vereinfacht kann man annehmen, dass die Elektronen auf bestimmten Bahnen um den Kern kreisen (Orbitale). Da ein Atom ungeladen ist, ist die Zahl der Protonen gleich der Zahl der Elektronen. Die meisten Atome kommen nur in Verbindungen vor. Die einzige Ausnahme sind die Edelgase, von denen nur wenige Edelgasverbindungen bekannt sind.
Valenzelektronen
Als Valenzelektronen bezeichnet man jene Elektronen, die bei einer chemischen Bindung mitwirken. Sie befinden sich auf der äußersten Schale, allerdings wirken beim D-Block (Übergangsmetalle) auch die Elektronen der zweitäußersten Schale mit, bei Lanthanoiden und Actinoiden sogar jene der drittäußersten. Die Außenschale ist im idealen Zustand, wenn sie voll besetzt ist, daher gilt die für alle Elemente der Hauptgruppen die Oktettregel (ausgenommen Wasserstoff und Helium, da die innerste Schale bereits mit 2 Elektronen voll besetzt ist), denn die Außenschale benötigt dazu insgesamt 8 Elektronen. Ab der dritten Periode können die Hauptgruppenelemente in Verbindungen ihr „Oktett erweitern“, wie z. B. der Schwefel in Schwefelsäure beweist. Die Edelgase, die den nach ihnen als „Edelgaszustand“ bezeichneten Zustand mit einer vollen Außenschale bereits haben, reagieren selten mit anderen Atomen.
Die Anzahl der Valenzelektronen lässt sich bei Hauptgruppenelementen durch einen Blick ins Periodensystem feststellen, die Elemente der 1.Hauptgruppe (Alkalimetalle) haben ein Außenelektron, die Elemente der 2. Hauptgruppe (Erdalkalimetalle) zwei usw.
Bei den Metallen im D-Block und der höheren Perioden kann es aber auch zu halb besetzten Schalen kommen, da auch dieser Zustand sehr stabil ist. Die genaue Zahl an Valenzelektronen ist im D-Block aus der Elektronenkonfiguration ersichtlich.
Elemente
Elemente bestehen aus Atomen mit identischer Ordnungszahl (auch Protonenzahl), aber nicht unbedingt gleicher Neutronenzahl (Elemente mit gleicher Ordnungszahl, aber unterschiedlicher Neutronen- und Massenzahl nennt man Isotope). Jedes Element reagiert auf eine bestimmte Art und Weise, doch lassen sich auch hier Periodizitäten erkennen, nach denen man die Elemente ordnen kann. In diesem Periodensystem verhalten sich untereinander stehende Elemente sehr ähnlich und werden zu Gruppen zusammengefasst. Alle Elemente einer Gruppe haben dieselbe Zahl an Außenelektronen. Waagrechte Zeilen im Periodensystem geben die Elemente mit der gleichen Zahl an Schalen wieder, wobei die Ordnungszahl von links nach rechts zunimmt.
Jedem Element im Periodensystem ist eine bestimmte Abkürzung zugeordnet, die sich an die lateinische Form des Namens anlehnt. Diese Kurzschreibweise ist insbesondere bei Summenformeln und Reaktionsgleichungen wichtig, da sie eine enorme Vereinfachung darstellt.
Beispiele: Eisen, lat.:ferrum, hat die Abkürzung Fe; Wasserstoff, lat.:hydrogenium, hat die Abkürzung H
Metalle
Metalle haben nur wenige und/oder weit vom Kern entfernte und daher schwach gebundene Valenzelektronen, welche sie leicht abgeben können (geringe Ionisierungsenergie, geringe Elektronegativität). Dadurch bilden sie oft positive Ionen, indem sie ihre Valenzelektronen abgeben und so die äußerste Schale auflösen. Die neue, tiefer liegende Außenschale ist stets voll besetzt und das entstandene Kation erfüllt so die Oktettregel.
Beispiele für Kationen mit Edelgaszustand: Na+, Mg2+, Al3+
Die Metalle des D-Blocks sowie jene der höheren Perioden können aber mehrere verschiedene Ionen bilden (z. B.: Fe2+ und Fe3+).
Im elementaren Zustand sind Metalle metallisch glänzende Feststoffe, die den elektrischen Strom leiten. Sie sind zudem gute Wärmeleiter und verformbar (duktil).
Nichtmetalle
Nichtmetalle haben viele Valenzelektronen, die fest an den Kern gebunden sind (hohe Ionisierungsenergie, hohe Elektronegativität). Sie erreichen den Edelgaszustand durch Elektronenaufnahme und bilden dadurch negativ geladene Anionen.
Beispiele für Anionen mit Edelgaszustand: N3−, O2−, F−
Eine weitere Möglichkeit für Nichtmetalle, die Oktettregel zu erfüllen, ist die kovalente Bindung.
Im elementaren Zustand leiten Nichtmetalle den elektrischen Strom nicht (Ausnahme: Graphit, eine Modifikation des Kohlenstoffs).
Halbmetalle
Die Halbmetalle lassen sich hierbei nicht wirklich einordnen, denn sie vereinigen in sich typische Eigenschaften beider Klassen (beispielsweise glänzen viele davon metallisch, sind aber schlechte Leiter). Ihre Elektronegativität und ihre Ionisierungsenergie liegt zwischen den entsprechenden Werten für Metalle und Nichtmetalle. Viele Elemente dieser Stoffklasse existieren in mehreren Modifikationen.
Verbindungen
Bindungsarten
Die Atome, aus denen alle uns umgebenden Materialien bestehen, können sich zu chemischen Verbindungen zusammenschließen. Im Allgemeinen unterscheidet man die folgenden 3 Grundtypen von Bindungen, wobei es aber durchaus auch Mischformen gibt:
Metallbindung
Sind die Summe und die Differenz der Elektronegativitäten der Bindungspartner klein, so kommt es zur Metallbindung. Die Atome geben ihre Außenelektronen ab und bilden ein Metallgitter, in dem die freien Außenelektronen frei beweglich sind. Diese freien Außenelektronen sind der Grund für die gute Wärme- und elektrische Leitfähigkeit von Metallen und Metalllegierungen. Weil es keine klar abgegrenzten Teilstücke gibt, haben Metalle und ihre Legierungen meist hohe Schmelz- und Siedepunkte. Beispiele für Metallbindung: Eisen (Fe), Bronze (Cu+Sn), Messing (Cu+Zn)
Ionenbindung
Bei einer großen Differenz der Elektronegativitäten (Nichtmetall+Metall) kommt es zur Ionenbindung (= Salz). Das Element mit der geringeren Elektronegativität gibt seine Außenelektronen ab, die vom Bindungspartner aufgenommen werden. Die dadurch entstehenden Ladungen sorgen für starke elektrostatische Kräfte, die Kationen und Anionen zusammenhalten. Salze sind elektrisch neutral, daher gibt es für jedes Salz ein bestimmtes Verhältnis von Kationenzahl zu Anionenzahl. Es bildet sich ein Kristallgitter, was zu einer schlechten Wärmeleitfähigkeit sowie einem hohen Schmelz- und Siedepunkt führt und außerdem für die Sprödigkeit von Salzen verantwortlich ist, da sich bei einer Deformation der Struktur gleichnamige Ladungen nebeneinander befinden und abstoßen. Als Feststoffe sind Salze Isolatoren, doch als Schmelze leiten sie den elektrischen Strom, weil es dann frei bewegliche Ladungsträger (Ionen) gibt. Beispiele für Ionenbindung: Kochsalz (Na+Cl−), Magnesiumoxid (Mg2+O2−)
Bei Übergangsmetallen muss deren Oxidationszahl im Namen angegeben werden: Eisen(II)-chlorid (Fe2+Cl−2), Eisen(III)chlorid (Fe3+Cl−3)
Mehratomige Ionen
Ein Ion kann auch mehrere Atome enthalten. Allgemein unterscheidet man hier hauptsächlich zwischen negativ geladenen Säurerestionen und positiv geladenen Ionen, die sich durch Anlagerung von H+ an Basen bilden. Die Ladung erkennt man an der Zahl der aufgenommenen beziehungsweise abgegebenen H+-Ionen.
Beispiele:
Salze können auch mehratomige Ionen enthalten: Ammoniumchlorid (NH4+Cl−), Natriumhydrogensulfat (Na+HSO4−)
Kovalente Bindung (Atombindung)
Ist die Summe der Elektronegativitäten groß, deren Differenz jedoch gering, bildet sich die kovalente Bindung (Nichtmetall+Nichtmetall). Die Bindungspartner teilen sich dabei ein oder mehrere Elektronenpaare, die dann zu beiden gehören. So erreichen sie den Edelgaszustand. Es gibt nach der Anzahl der bindenden Elektronenpaare Einfach- und Mehrfachbindungen, was sich in der Lewis-Formel widerspiegelt. Auch bei der Atombindung gibt es feste Zahlenverhältnisse, da jedes beteiligte Atom ein Oktett erhält.
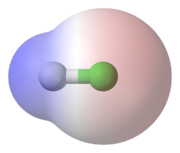 Chlorwasserstoff als Kugelstabmodell mit eingefärbtem Van-der-Waals-Radius; rot ist partiell negativ, blau ist partiell positiv geladen
Chlorwasserstoff als Kugelstabmodell mit eingefärbtem Van-der-Waals-Radius; rot ist partiell negativ, blau ist partiell positiv geladenSo verbinden sich beispielsweise immer je ein Atom Chlor und Wasserstoff zur Verbindung Chlorwasserstoff.
Weil die starken Bindungskräfte hier nur zwischen je zwei Atomen wirken, bilden sich klar abgegrenzte Strukturen heraus, diese nennt man Moleküle. Weil sie untereinander nur schwach wechselwirken, sind die Schmelz- und Siedepunkte von Substanzen mit Atombindung meist relativ niedrig. Beispiel: Kohlendioxid (CO2) Da es aber auch bei der kovalenten Bindung geringe Elektronegativitätsunterschiede gibt, kann es zu einer Polarisierung des Moleküles kommen. Der elektronegativere Bindungspartner zieht die bindenden Elektronen zu sich, was zu Partialladungen im Molekül führt.
Stoffe mit kovalenter Bindung bestehen aus Molekülen, sind Nichtleiter (Isolatoren) und – je nach Polarität und Molekülgröße – relativ flüchtig, sofern es sich nicht um kunststoff- oder diamantähnliche Riesenmoleküle handelt. So sind Schwefelwasserstoff und Ammoniak relativ flüchtig (schwach polar), Wasserstoffgas extrem flüchtig (unpolar) und Wasser und Chlorwasserstoff (HCl) weniger flüchtig (stark polarisierte Bindung) – nichtflüchtige Stoffe mit Atombindungen hingegen bestehen aus Riesenmolekülen (Beispiele: Diamant, Polyethylen, Stärke).
Strukturchemie
Für die chemischen Eigenschaften einer Verbindung ist es jedoch nicht nur entscheidend, welche Atome sie enthält, sondern auch, wie diese miteinander verbunden sind (siehe Chemische Bindung). Bei bestimmten chemischen Verbindungen, vor allem bei Proteinen und anderen organischen Verbindungen, sind nicht nur die Bindungen zwischen den Atomen maßgeblich für die chemischen Eigenschaften, sondern auch deren räumliche Ausrichtung (siehe Isomerie).
Die Herausforderung in der chemischen Synthese besteht daher in der Regel darin, selektiv Bindungen zwischen einzelnen Atomen der Reaktandmoleküle zu lösen und/oder zu knüpfen, um dadurch eine gewünschte Substanz (Reaktionsprodukt) herzustellen.
Reinstoffe
Reinstoffe bestehen immer nur aus einer Art von Verbindung. Sie haben einen fixen Schmelz- und Siedepunkte und bestimmte Physikalische und chemische Eigenschaften. Sie lassen sich mithilfe von Summenformeln beschreiben, die die Zahlenverhältnisse angeben. Alle Elemente können gleichzeitig auch dieser Kategorie zugeordnet werden.
Beispiele für Reinstoffe (mit Summenformel): Wasser (H2O), Kochsalz (NaCl), Sauerstoff (O2)
Reinstoffe lassen sich nur mit chemischen Mitteln weiter zerlegen.
Gemenge
Gemenge (Stoffgemische) enthalten verschiedene Arten von Reinstoffen, sie haben einen Schmelz- und Siedebereich. Man unterscheidet hier zwischen homogenen und heterogenen Gemengen.
Homogene Gemenge
Bei einem homogenen Gemenge sind die Bestandteile auf molekularer Ebene vollkommen durchmischt, sodass sie sich nicht mehr z. B.: durch bloße Filtration voneinander trennen lassen. Ein homogenes Gemenge erscheint von Außen wie ein großes Ganzes.
Beispiele für homogene Gemenge: Salzlösungen, Luft, Legierungen
Homogene Gemenge lassen sich aber aufgrund der unterschiedlichen Siede- und Schmelzpunkte der Komponenten durch physikalische Verfahren wie z. B.: Destillation trennen.
Heterogene Gemenge
Bei einem heterogenen Gemenge ist die Durchmischung nicht vollständig. Es liegen immer klar getrennte Phasen vor, die sich relativ leicht voneinander trennen lassen.
Beispiele für heterogene Gemenge: aufgewirbelter Staub, Tabakrauch, Badeschaum, Schlamm, Erde, Suspensionen, Emulsionen
Chemische Reaktionen
- Hauptartikel: Chemische Reaktionen
Die Chemie kennt eine Vielzahl verschiedener Arten chemischer Reaktionen. Sie haben jedoch alle gemeinsam, dass mindestens ein Stoff umgesetzt wird (Stoffumwandlung = chemische Reaktion). Bei den beteiligten Stoffen unterscheidet man Edukte (Ausgangsstoffe) und Produkte (Endstoffe). Allgemein wird eine Reaktion mithilfe einer Reaktionsgleichung angeschrieben (auch als Reaktionsschema bezeichnet):
Bei den meisten Reaktionen findet diese aber nicht nur in Richtung der Produkte statt, sondern es gibt auch eine Rückreaktion. Um dies zu betonen, schreibt man:
Aus diesem vereinfachten Grundtyp eines Reaktionsschemas lassen sich alle anderen ableiten. Mit Zahlen vor den Reaktanden (Koeffizienten) wird zusätzlich noch das Molzahlenverhältnis angegeben, wobei die „1“ nicht geschrieben wird. Es sind in Ausnahmefällen auch Bruchzahlen als Koeffizienten möglich.
Beispiel: Bildung von Wasser aus den Elementen:
Beispiel für eine reversible (umkehrbare) Reaktion: Boudouard-Gleichgewicht:
Chemisches Gleichgewicht
- Hauptartikel: Chemisches Gleichgewicht
Das chemische Gleichgewicht ist ein Zustand des dynamischen Gleichgewichtes in einem System, was bedeutet, dass von außen keine Reaktion mehr zu beobachten ist, obwohl sie immer noch stattfindet. Der Grund dafür, dass der äußere Zustand des Systems unverändert bleibt, ist, dass die Hin- und Rückreaktion im gleichen Tempo verlaufen. Dieses dynamische Gleichgewicht lässt sich beweisen, indem man einige Moleküle markiert. Anhand eines konkreten Beispieles möchte ich das erläutern:
Wir nehmen folgende Gleichgewichtsreaktion:
Die Prozentsätze im Gleichgewicht lassen sich, wie im Absatz „Konstanten und Formeln“ beschrieben, berechnen und werden in einen Behälter gefüllt, wobei aber anstatt des normalen Wasserstoffisotops Protium mit einem Proton im Kern das Isotop Deuterium mit einem Proton und einem Neutron benutzt wird. Nach außen hin ist keine Reaktion zu erkennen, da sich das System ja im Gleichgewicht befindet, doch wenn man den Inhalt des Gefäßes nach einigen Tagen wieder untersucht, wird man feststellen, dass die Deuterium-Atome sowohl im Ammoniak als auch im Wasserstoff zu finden sind.
Berechnungen zum chemischen Gleichgewicht
Für beliebige Gleichgewichte kann man die sogenannte Thermodynamische Gleichgewichtskonstante K definieren, die die Lage des Gleichgewichts beschreibt. Es gilt:
mit Aktivitäten a und Stöchiometrischen Koeffizienten ν. Diese Gleichgewichtskonstante ist mit der freien Reaktionsenthalpie über
gekoppelt.
Für eine einfache Gleichgewichtsreaktion
gilt dann beispielsweise
In vielen Fällen lässt sich die Aktivität näherungsweise durch die Konzentration c des Stoffes ersetzen. Die Gleichgewichtskonstante wird dann zur besseren Kennzeichnung mit Kc bezeichnet. Weiterhin ist es möglich, Gleichgewichtskonstanten mit dem Stoffmengenanteil x oder dem Partialdruck p aufzustellen. Diese besitzen jedoch dann einen anderen Zahlenwert und können daher nicht direkt in die Gleichungen der Thermodynamik eingesetzt werden. Sie müssen also vorher in „K's“ umgerechnet werden. Beispielsweise gilt für die Konstante KX in unserem Beispiel
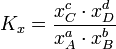 .
.
Analog gilt für Kp:
An der bereits vorher aufgestellten Reaktionsgleichung zur Bildung von Ammoniak kann man nun die Berechnung von z. B. Kx demonstrieren:
Beeinflussung des Gleichgewichtes
Nach dem Prinzip von LeChatelier (Prinzip vom kleinsten Zwang) versucht ein System, äußeren Zwängen auszuweichen. Wenn bei einer Reaktion eine Verringerung des Volumens auftritt, so wird eine Druckerhöhung die Hinreaktion beschleunigen. Umgekehrt wiederum beschleunigt eine Druckverminderung die Rückreaktion. Wächst die Enthalpie bei einer endothermen Reaktion, so kann ein Temperaturanstieg diese beschleunigen. Dieses Prinzip wird von der Industrie häufig genutzt, um die Ausbeute zu erhöhen.
Eine weitere Besonderheit des chemischen Gleichgewichtes ist, dass es sich immer wieder neu einstellt, wenn ein Teil des Reaktionsgemisches entfernt wird, wodurch sich die Ausbeute manchmal enorm steigern lässt:
Gegeben sei eine Veresterung mit niedriger Gleichgewichtskonstante:
Setzt man nun wasserentziehende Reagenzien zu, so wird die Reaktion trotz der niedrigen Gleichgewichtskonstante vollständig auf die rechte Seite verlaufen, da die Rückreaktion ohne Wasser nicht mehr möglich ist.
Katalysatoren
Katalysatoren setzen die Aktivierungsenergie für eine Reaktion herab, indem sie den Reaktionsweg über Zwischenstufen leiten, wobei der Energieaufwand für diesen Weg weitaus geringer ist als für die direkte Variante. Katalysatoren werden nicht umgesetzt, d. h. die Stoffmenge an Katalysator vor der Reaktion ist gleich der Stoffmenge nach der Reaktion. Katalysatoren beeinflussen zwar die Reaktionsgeschwindigkeit und somit auch die Zeit bis zur Gleichgewichtseinstellung, aber nicht die Lage des Gleichgewichts.
Wichtige anorganische Reaktionen
Bildung aus den Elementen
Beispiele:
Bildung von Methan:
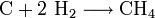
Bildung von Schwefelwasserstoff:
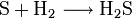
Redoxreaktionen
Unter dem Begriff „Redoxreaktionen“ werden die Oxidation und die Reduktion zusammengefasst. Diese völlig gegenteiligen Reaktionen sind bei der Oxidation Elektronenabgabe (veraltet: Sauerstoffaufnahme/Wasserstoffabgabe) und bei der Reduktion Elektronenaufnahme (veraltet: Sauerstoffabgabe/Wasserstoffaufnahme). Rasche Oxidation wird auch als „Verbrennung“ bezeichnet. Wenn ein Stoff Elektronen aufnimmt, muss sie ein anderer Stoff zuvor abgegeben haben. Daher kommen Reduktion und Oxidation stets gemeinsam vor. Das ist bei Erstellen eines Reaktionsschemas für Redoxreaktionen zu berücksichtigen. Substanzen, die andere Substanzen leicht oxidieren können, nennt man Oxidationsmittel, Substanzen, die andere Substanzen leicht reduzieren können, heißen Reduktionsmittel. Reduktionsmittel geben Elektronen ab, Oxidationsmittel nehmen sie auf. (Auch Säure-Base-Reaktionen fallen prinzipiell in diese Kategorie, wobei die Säure oxidiert und die Base reduziert wird, obwohl viele diese als eigenen Reaktionsmechanismus auffassen, da hier ja Protonen statt Elektronen ausgetauscht werden).
Beispiele:
Verbrennung von Schwefel:
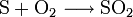
Reaktion von Fluor mit Natrium:
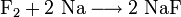
Säure-Base-Reaktionen
Nach der Säure-Base-Theorie nach Brønsted ist eine Säure ein Protonendonator und eine Base ein Protonenakzeptor. Die Säure gibt bei Säure-Base-Reaktionen ein Wasserstoffion ab, welches von einer Base aufgenommen wird. Wenn eine Säure mit einer Base reagiert, nennt man diesen Vorgang Neutralisation, da das entstehende Salz einen weniger sauren/basischen pH-Wert hat als die Ausgangssubstanzen. Handelt es sich bei der Base um ein Metallhydroxid, entsteht als Nebenprodukt Wasser. Sie unterscheiden sich von den Redoxreaktionen nur durch das Vorzeichen der übertragenen Ladung, die in diesem Fall ein H+-Ion ist.
Beispiele:
Bildung von Kochsalz:
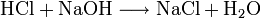
Bildung von Kaliumbromid:
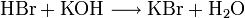
Bildung von Ammoniumchlorid:
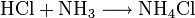
Die Säure-Base-Theorie nach Lewis entspricht der Oxidation, wobei eine Lewis-Säure ein Elektronenakzeptor und eine Lewis-Base ein Elektronendonator ist. Der einzige Unterschied ist, dass bei Lewis-Säuren/Basen immer Elektronenpaare anstatt einzelner Elektronen abgegeben/aufgenommen werden.
Reaktion von Oxiden mit Wasser
Nichtmetalloxide reagieren mit Wasser unter Bildung einer Säure, Metalloxide bilden mit Wasser ein Metallhydroxid (Base).
Beispiele:
Bildung von Schwefelsäure:
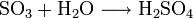
Bildung von Kieselsäure:
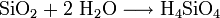
Bildung von Aluminiumhydroxid:
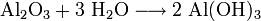
Bildung von Kaliumhydroxid:
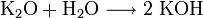
Reaktion von Säuren mit Metallen
Säuren bilden mit Metallen Salze, wobei die Säure die aciden H-Atome durch ein Metall ersetzt. Als Nebenprodukt entsteht bei dieser Reaktion Wasserstoff. Beispiel für eine einprotonige Säure und ein Erdalkalimetall (2.Hauptgruppe).
Me: Metall; R: Säurerest; H: Wasserstoffatom
Diese Reaktion ist umso lebhafter, je stärker und je konzentrierter die Säure und je unedler das Metall ist. Ist die Stärke der Säure zu schwach und/oder das Metall zu edel, kommt es zu keiner oder bestenfalls zu einer schwachen Reaktion. Auch die Bildung einer Passivisierungsschicht kann diese Reaktion unterbinden.
Beispiele:
Reaktion von Schwefelsäure mit Natrium:
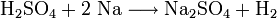
Reaktion von Salpetersäure mit Kalium:
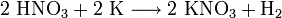
Aber: Reaktion von Kohlensäure mit Kupfer:
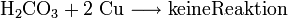 (Säure zu schwach und Metall zu edel)
(Säure zu schwach und Metall zu edel)Komplexbildungsreaktion
Sehr häufig kommt es in der anorganischen Chemie zur Bildung von farbigen Komplexen. Viele solcher Reaktionen sind gute Nachweisreaktionen.
Das allgemeine Bauprinzip von Komplexen ist sehr einfach:
Um ein Zentralatom (meist ein Metallion) lagern sich bei einer Komplexbildungsreaktion nach einem bestimmten Schema Liganden an und sorgen so beispielsweise für eine massive Verbesserung der Löslichkeit. Diese Liganden gehen dabei eine koordinative Bindung mit dem Zentralatom ein. Je nach Koordinationszahl (Zahl der Liganden an einem Zentralatom), Größe, Polarität und Ladung kommt es hierbei zur Ausbildung von verschiedenen geometrischen Körpern.
Nachweisreaktionen
Um in unbekannten Stoffproben bestimmte Stoffe zu identifizieren, setzt man Nachweismittel zu. Diese reagieren mit dem gesuchten Stoff in bekannter Weise (Säure-Base-, Redox-, Komplexbildungs- und Fällungsreaktionen – siehe unter Nachweisreaktionen). Nachweisreaktionen zeichnen sich durch gute Erkennbarkeit aus, so dass z. B. charakteristisch gefärbte Lösungen und Niederschläge sowie spezifische Gerüche auftreten. Eventuell ähnlich reagierende Stoffe müssen zuvor abgetrennt oder maskiert werden (vgl. Kationentrenngang).
Wichtige organische Reaktionen
Siehe Namensreaktionen
Siehe auch
- Portal:Chemie
- Substanzen
- Verbindungen
- Chemikalienliste
- Liste der Säuren
- Liste der Laborgeräte
- chemische Gefahrenzeichen
- Liste der Liganden-Abkürzungen
Wikimedia Foundation.




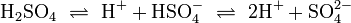
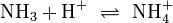
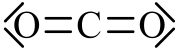


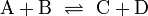
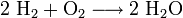
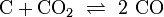
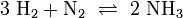
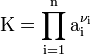
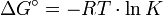
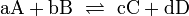
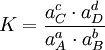
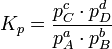
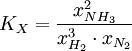

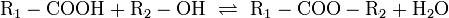

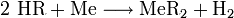
6.png)