- Neutralisationsreaktion
-
Unter einer Neutralisation wird in der Chemie die Aufhebung der (unter anderem) ätzenden Wirkung von Säuren oder Basen (= Laugen) verstanden. Die Grundlage der Neutralisation beruht auf der Tatsache, dass sich die Wirkungen einer Säure und einer Base beim Mischen nicht addieren, sondern aufheben. So kann eine Säure mit einer geeigneten Menge einer Base und eine Base mit einer geeigneten Menge einer Säure neutralisiert werden.
In der Regel finden die Reaktionen in wässrigen Lösungen statt. Starke Säuren bilden in Wasser vollständig gelöste H3O+-Ionen, starke Basen vollständig gelöste OH−-Ionen. Werden solche Lösungen zusammengegeben, bilden sich aus den Oxoniumionen und den Hydroxidionen Wasser.
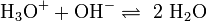
- Säure + Base reagiert zu Wasser
Eine Säure und eine Base sind vollständig neutralisiert, wenn der Neutralpunkt, also der pH-Wert sieben erreicht wird. Die Neutralisation setzt große Energiemengen frei, es handelt sich um eine exotherme Reaktion, es wird Wärmeenergie abgegeben. Hierbei wächst die Heftigkeit der Reaktion mit der verwendeten Konzentration, während bei einer Reaktion mit Konzentrationen von c = 1 mol/l kaum effekte sichtbar sind, verlaufen Neutralisationen mit hohen Konzentrationen der Reaktionspartner (z. B. mit 98-prozentiger Schwefelsäure) überaus heftig und sind dementsprechend gefährlich.
Beispiel:
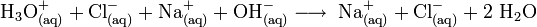
- Salzsäure + Natronlauge reagiert zu, in Wasser, gelöstem Natriumchlorid und Wasser. (Bemerkung: In einigen Lehrbüchern wird gesagt: „reagieren zu Salz + Wasser“. Diese historische Formulierung steht im Zusammenhang mit dem Nachweis der Reaktionsprodukte durch Eindampfen der Lösung. Die bei der Neutralisation entstandenen Salze sind in der Regel im Wasser gelöst.)
Wird eine schwache Säure mit einer starken Base oder eine schwache Base mit einer starken Säure neutralisiert, kann der pH-Wert, bei dem eine vollständige Neutralisation vorliegt, unterschiedlich aufgefasst werden. Der oben genannte pH-Wert sieben entspricht dem Wert von reinem Wasser und kann als „neutral“ bezeichnet werden, da die „ätzenden Wirkungen“ vollständig aufgehoben sind. Die Komponenten der Säuren und Basen liegen beim Neutralpunkt aber nicht in gleicher Menge vor. In der Chemie wird bei einer vollständigen Neutralisation der pH-Wert beim Äquivalenzpunkt bevorzugt als neutral bezeichnet. Hier liegen Säuren und Basen in gleicher Menge vor, der pH-Wert weicht aber von sieben ab.
Siehe auch
Weblinks
Wikimedia Foundation.
