- Ninhydrinreaktion
-
Strukturformel 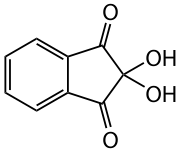
Allgemeines Name Ninhydrin Andere Namen - 2,2-Dihydroxyhydrinden-1,3-dion
- 2,2-Dihydroxyindan-1,3-dion
- Indantrionhydrat
- 2,2-Dihydroxy-1,3-indendion
- 2,2-Dihydroxy-1H-inden-1,3(2H)-dion
Summenformel C9H6O4 CAS-Nummer 485-47-2 PubChem 10236 Eigenschaften Molare Masse 178,15 g·mol-1 Aggregatzustand fest
Schmelzpunkt Löslichkeit wenig in Wasser bei 20 °C (20 g·l-1)[1], leicht in siedendem Wasser, Alkoholen, wenig in Ether
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/37/38 S: 26-28-36 WGK 2 – wassergefährdend [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ninhydrin ist ein Reagens zum Nachweis von Ammoniak und primären Aminogruppen, insbesondere von Aminosäuren.
Inhaltsverzeichnis
Eigenschaften
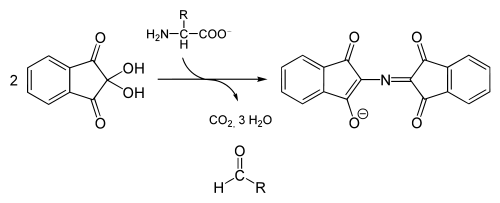
Ninhydrin reagiert mit der Aminogruppe von Aminosäuren unter Wasserabspaltung zu einer Schiffschen Base (Imin). Nach Decarboxylierung der Carboxylgruppe der Aminosäure und anschließender Abspaltung des Aminosäure-Restes entsteht Amino-Ninhydrin. Dieses dimerisiert mit Ninhydrin zu einem blauen Farbstoff (Ruhemanns Purpur). Die intensive blaue Farbe kann durch Mesomerie unter der Beteiligung einer Wasserstoffbrückenbindung innerhalb des Systems konjugierter Doppelbindungen erklärt werden.
Die Intensität der Farbe ist der Konzentration des Farbstoffes (siehe Lambert-Beersches Gesetz) und damit der Konzentration einer zu bestimmenden Aminosäure proportional. Zur quantitativen Analyse werden photometrisch bei 570 nm mehrere Proben mit bekannter Konzentration als Standards mit der zu untersuchenden Probe verglichen. Bei der Reaktion mit sekundären Aminosäuren, wie Prolin oder Hydroxyprolin, entsteht ein gelber Farbkomplex welcher bei 400nm photometrisch gemessen werden kann.
Die Reaktion ist relativ empfindlich, die Nachweisgrenze liegt bei 0,001 bis 0,1 mg.
Verwendung
Ninhydrin wird vor allem für den Nachweis von Aminosäuren und Proteinen verwendet. Für Proteine ist der Test jedoch nur erfolgreich, wenn relativ kurze Oligopeptide vorliegen, da Ninhydrin nur mit freien Aminogruppen reagiert und diese bei langkettigen Polypeptiden kaum vorhanden sind. Der Nachweis wird in Lösung (unter Erhitzen im Wasserbad) durchgeführt. Ninhydrin wird häufig auch als Sprühreagens z. B. bei der Papierchromatografie oder Dünnschichtchromatographie verwendet.
Eine weitere auf dieser Reaktion basierende Anwendung ist die Erstellung von Fingerabdrücken. Da im Schweiß Aminosäuren vorkommen, können diese mit Ninhydrin reagieren und die Finger- bzw. Handabdrücke sichtbar machen.
Dieser Mechanismus findet auch in der Medizin als sogenannter Moberg-Test Anwendung zum Nachweis peripherer Nervenläsionen. Da die für die Schweißsekretion regulierenden sympathischen Fasern ab dem Austritt aus dem Rückenmark gemeinsam mit den peripheren Nervenbahnen verlaufen, ist auch die Schweißsekretion gestört, was sich an einem abgenommenen Hautabdruck mittels Ninhydrin nachweisen lässt.
Eine Ausnahme bildet die Aminosäure Prolin bzw. Hydroxyprolin, die als sekundäre Aminosäuren statt einer primären (NH2) eine sekundäre (NH) Aminogruppe besitzen. Prolin und Hydroxyprolin reagieren über einen anderen Reaktionsmechanismus zu einem gelbroten Produkt mit einem Absorptionsmaximum bei 440 nm.
Quellen
- ↑ a b c d Eintrag zu Ninhydrin in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 16. Januar 2008 (JavaScript erforderlich)
Literatur
- Siegfried Ruhemann (1910): Cyclic di- and tri-ketones. In: Journal of the Chemical Society Transactions. 97, S. 1438–1449. doi:10.1039/CT9109701438
Weblinks
Wikimedia Foundation.