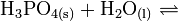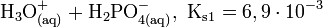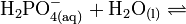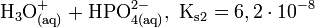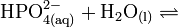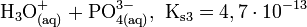- Orthophosphorsäure
-
Strukturformel 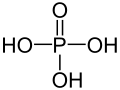
Allgemeines Name Phosphorsäure Andere Namen - ortho-Phosphorsäure
- Phosphor(V)-säure
Summenformel H3PO4 CAS-Nummer 7664-38-2 PubChem 1004 Kurzbeschreibung farb- und geruchloser Feststoff Eigenschaften Molare Masse 98,00 g·mol−1 Aggregatzustand fest (oft flüssig, da eine unterkühlte Schmelze recht lange lagerbar ist)
Dichte Schmelzpunkt 42,35 °C [1]
Siedepunkt Zersetzung: 213 °C (Wasserabspaltung) [1]
Dampfdruck pKs-Wert 2,16; 7,21; 12,32 [2]
Löslichkeit vollständig mischbar mit Wasser [1], gut löslich in Alkohol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Ätzend (C) R- und S-Sätze R: 34 S: (1/2)-26-45 MAK 2 mg·m−3 (einatembarer Aerosolanteil) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die „normale“ oder ortho-Phosphorsäure ist die wichtigste Sauerstoffsäure des Phosphors. Sie ist eine dreiprotonige Säure und reagiert bezüglich der ersten Deprotonierung als mittelstarke Säure. Ihre Salze und Ester heißen Phosphate. Der Phosphor hat in diesen Verbindungen die Oxidationsstufe V.
Von der Phosphorsäure leiten sich außerdem die Kondensate Diphosphorsäure, Meta- und Polyphosphorsäuren ab.
Als Lebensmittelzusatzstoff wird Phosphorsäure als E 338 deklariert.
Inhaltsverzeichnis
Gewinnung und Darstellung
Phosphorsäure kann aus Rohphosphat (meistens Apatit, Ca5(PO4)3(F, OH, Cl)) mit Schwefelsäure, Salzsäure oder Salpetersäure hergestellt werden. Als Nebenprodukte fallen dabei CaSO4 (Anhydrit, Gips) und H2[SiF6] (Hexafluorokieselsäure) an. Alternativ lässt sich Phosphorsäure durch Verbrennung elementaren Phosphors zu Phosphorpentoxid, P4O10, und anschließende Hydrolyse herstellen (sogenannte thermische Phosphorsäure). Ein hochreines Produkt erhält man durch Verdampfen im Vakuum.[4]
Eigenschaften
Die wasserfreie Substanz ist stark hygroskopisch.
Die Phosphorsäure ist eine dreiwertige Säure, die ihren Wasserstoff als solvatisierte Protonen in drei Stufen unter Bildung von Dihydrogenphosphat-, Hydrogenphosphat- und Phosphat-Anionen abgeben kann. Die zugehörigen pKs-Werte betragen pKs1 = 2,161; pKs2 = 7,207 und pKs3 = 12,325[2].
Verwendung
Phosphorsäuren dienen als Ausgangsstoff zur Herstellung phosphathaltiger Dünger (in den USA >90 % der Produktion), von Waschmitteln, Rostentfernern bzw. von Rostumwandler sowie zur Passivierung von Eisen und Zink zum Schutz vor Korrosion. In der Zahnmedizin findet Zinkphosphatzement Verwendung.
Während sie in hoher Konzentration ätzend wirkt, wird sie verdünnt in der Lebensmittelindustrie als Konservierungsmittel, Säuerungsmittel (vor allem in Cola-Getränken) sowie als Säureregulator eingesetzt (E 338), denn die Phosphorsäure ist bis auf ihre ätzende Wirkung für den menschlichen Organismus ungiftig. Sie eignet sich auch zur Herstellung von Pufferlösungen (verschiedene „Phosphatpuffer“).
Biologische Bedeutung
Phosphorsäureester spielen im Stoffwechsel eine zentrale Rolle, insbesondere als Energie- und Gruppenüberträger (siehe z. B. ATP bzw. GTP). Sie sind unter anderem integraler Bestandteil der DNA, der RNA und vieler Coenzyme.
Nachweis
Die Phosphorsäure und lösliche Phosphate lassen sich durch Fällung mit Ammoniummolybdat zu gelbem Ammoniummolybdatophosphat, oder durch Fällung mit Magnesiumionen in ammoniakalischer Lösung zu MgNH4PO4 nachweisen.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 7664-38-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3. März 2007 (JavaScript erforderlich)
- ↑ a b RÖMPP Online, Thieme 2007
- ↑ Eintrag zu CAS-Nr. 7664-38-2 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 543-4.
Quellen
- A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin u. New York 1995, S. 764.
Siehe auch
Weblinks
Wikimedia Foundation.