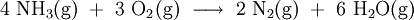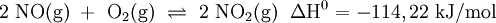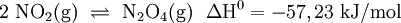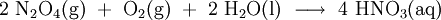- Ostwald-Verfahren
-
Das Ostwaldverfahren dient der großtechnischen Herstellung von Salpetersäure durch Oxidation von Ammoniak, welcher vorzugsweise durch das Haber-Bosch-Verfahren gewonnen wird. Es geht auf den deutschen Chemiker Wilhelm Ostwald zurück (Patent, 1902). Die grundlegende chemische Reaktion wurde bereits 1838 von Fr. Kuhlmann patentiert.
Inhaltsverzeichnis
Beschreibung
Das Verfahren läuft in drei Teilschritten ab. Es baut auf dem im Haber-Bosch-Verfahren erzeugten Ammoniakgas. Weitere Ausgangsstoffe sind Luft und Wasser.
Schritt 1: Katalytische Verbrennung von Ammoniakgas
Im ersten Schritt wird Ammoniak (NH3) mit Sauerstoff (O2) gemischt und in Gegenwart eines Platin-Rhodium-Katalysators bei 600 bis 700 °C zu Wasser (H2O) und Stickstoffmonoxid (NO) umgesetzt (Bei neueren Anlagen wird ein spezielles Rückgewinnungsnetz eingesetzt, um das teure Platin zurückzugewinnen). Das Gasgemisch darf den Katalysator nur ganz kurz – nur etwa eine tausendstel Sekunde – berühren, da ansonsten das Stickstoffmonoxid wieder in die Elemente zerfällt:
Eine unerwünschte Nebenreaktion, die auch ohne Katalysator abläuft, ist die Oxidation des Ammoniaks zu elementarem Stickstoff unter Bildung von Wasser:
Die Reaktion wird durch eine möglichst hohe Netztemperatur und niedrigen Druck zurückgedrängt (s. Prinzip von Le Chatelier).
Schritt 2: Erzeugung von Stickstoffdioxid
In Schritt 2 senkt man die Temperatur des Stickstoffmonoxids (NO) auf unter 50 °C und mischt es mit Luft. Es läuft eine weitere Oxidation mit Sauerstoff (O2) zu Stickstoffdioxid (NO2) ab, welches anschließend zu Distickstofftetraoxid dimerisiert:
Schritt 3: Reaktion in der Oxidations- und Absorptionskolonne
Die Stickoxide werden im 3. Schritt in Rieseltürmen mit Wasser zu Salpetersäure (HNO3) umgesetzt:
Als Zwischenprodukte entstehen hierbei Stickstoffmonoxid (NO) und die Salpetrige Säure (HNO2), denn die Reaktion verläuft über folgende Zwischenschritte:
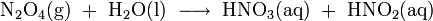
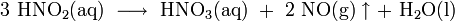
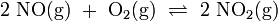 (wie Schritt 2)
(wie Schritt 2)
Literatur
- Fr. Kuhlmann: Abhandlung über die Salpeterbildung. Neue Erzeugung von Salpetersäure und Ammoniak. In: Annalen der Pharmacie. 29, Nr. 1, 1839, ISSN 0365-5490, S. 272–279 (doi:10.1002/jlac.18390290305).
- Erwin Riedel: Anorganische Chemie. de Gruyter, Berlin 2004, ISBN 3-11-018168-1.
Siehe auch
Wikimedia Foundation.




![\mathrm{4\ NH_3(g)\ +\ 5\ O_2(g)\ \xrightarrow [Pt / Pt-Rh]{600-700\ ^{\circ}C}}](/pictures/dewiki/100/ddfe426057fc66edd1c50213c2723bb8.png)