- Phosphoglycerat-Kinase
-
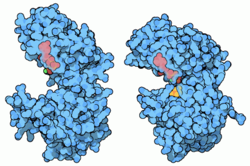
Phosphoglyceratkinase Kalottenmodelle der PGK, mit ADP (grau) und PG (gelb). Links: offen (inaktiv, nach PDB 3PGK). Rechts: geschlossen (aktiv, PDB 1VPE). Vorhandene Strukturdaten: 2zgv, 3c39, 3c3a, 3c3b, 3c3c Größe 416 Aminosäuren Struktur Monomer Bezeichner Gen-Namen PGK1; PGK2 Externe IDs OMIM: 311800 UniProt: P00558 Enzymklassifikation EC, Kategorie 2.7.2.3 Kinase Reaktionsart (De-)Phosphorylierung Substrat ATP + 3-Phospho-D-glycerat Produkte ADP + 1,3-Biphospho-D-glycerat Vorkommen Homologie-Familie PGK Übergeordnetes Taxon Lebewesen Phosphoglyceratkinase (PGK) ist der Name für das Enzym, das dem Stoff Phosphoglycerat (PG) eine Phosphat-Gruppe hinzufügt. Die umgekehrte Reaktion, das Entfernen von Phosphat von 1,3-Bisphosphoglycerat (BPG) wird ebenso von PGK katalysiert und ist Teilschritt der Glykolyse, der Verwertung von Kohlenhydraten im Stoffwechsel aller Lebewesen. Mutationen im PGK-Gen können beim Menschen zu PGK-Mangel führen und zu hämolytischer Anämie.[1]
Mit den Säugetieren hat sich eine zweite Isoform der PGK entwickelt (PGK2), die ausschließlich in den Hoden lokalisiert ist. Sie ist sehr wahrscheinlich durch Kopie des mRNA-Transkripts des PGK1-Gens mittels reverser Transkriptase entstanden, ein so genanntes Retrogen. PGK2 wird nur während der Spermatogenese exprimiert, als Ersatz für PGK1, deren Gen auf dem X-Chromosom lokalisiert ist, und deren Produktion daher in dieser Phase ruht.[2]
Die Bildung von PGK wird insbesondere von HIF-1 aktiviert. Eine weitere Funktion der PGK1 außerhalb der Glycolyse ist als Disulfid-Reduktase bei der Bildung von Blutgefäßen in Tumoren, wo sie durch CXCR4 aktiviert wird. PGK1 ist damit auch Teil der Signaltransduktion.[3][4]
Katalysierte Reaktion
Phosphat wird von 1,3-Bisphosphoglycerat auf ADP übertragen und umgekehrt.
Einzelnachweise
- ↑ UniProt P00558
- ↑ OMIM: PGK2
- ↑ OMIM: PGK1
- ↑ J. Wang et al.: A glycolytic mechanism regulating an angiogenic switch in prostate cancer. Cancer Res. 67/1/2007:149-59. PMID 17210694
Weblinks
Wikimedia Foundation.