- Porine
-
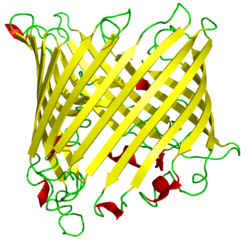
Porine Schematische Darstellung eines Sucrose spezifischen Porins aus Salmonellen:[1] Seitenansicht (parallel zur Membran) der β-Fass-Struktur mit den antiparallelen β-Faltblättern im Bändermodell für das Monomer. Masse/Länge Primärstruktur 300-420 Aminosäuren Transporter-Klassifikation TCDB 1.B Bezeichnung Β-Fass-Porine Vorkommen Übergeordnetes Taxon Mitochondrien, Plastiden, Bakterien Ausnahmen manche gram-positive Bakterien Porine sind porenformende Transmembranproteine in der äußeren Membran von gramnegativen Bakterien, Chloroplasten und Mitochondrien. Sie dienen dem Stoffaustausch durch die Membran hindurch.
Es herrscht bei allen Porinen ein übereinstimmendes Konstruktionsprinzip vor: Sie bestehen aus einer Kette von 300–420 Aminosäuren, die zu einem 16- oder 18-strängigen antiparallelen β-Fass gefaltet ist (ein Strang entspricht einem β-Faltblatt). Die Wandung der Pore ist sehr dünn; sie besitzt nur die Stärke von einer Aminosäure. Im Innern des Porins befindet sich eine Engstelle mit einigen ionisierbaren Aminosäuren, an der die Durchlasseigenschaften der Pore festgelegt werden.
Wenn man die Porine unterschiedlicher Arten untersucht, stellt man fest, dass sie sich in etlichen Strukturmerkmalen ähneln. Dies deutet auf Homologie und kann als Beleg dafür herangezogen werden, dass es sich bei den Porinen um sehr konservative Proteine handelt, die sich im Verlauf der Evolution nur wenig verändert haben.
Mitochondriales Porin (Ø ~4 nm) liegt in der äußeren mitochondrialen Membran und ermöglicht die freie Diffusion von Molekülen bis etwa 5000 Da. Es wird auch als VDAC (voltage dependend anion channel) bezeichnet, da es den geregelten Durchtritt von anionischen Molekülen wie Chlorid, Phosphat oder Nukleotiden erlaubt.[2]
Einzelnachweise
- ↑ Forst, D. et al. (1998): Structure of the sucrose-specific porin ScrY from Salmonella typhimurium and its complex with sucrose. In: Nat. Struct. Biol. Bd. 5, S. 37-46. PMID 9437428 PDB 1A0S
- ↑ Vander Heiden MG, Li XX, Gottleib E, Hill RB, Thompson CB, Colombini M: Bcl-xL promotes the open configuration of the voltage-dependent anion channel and metabolite passage through the outer mitochondrial membrane. In: J. Biol. Chem.. 276, Nr. 22, Juni 2001, S. 19414–9. doi:10.1074/jbc.M101590200. PMID 11259441.
Literatur
- Hiroshi Nikaido (2003): Molecular Basis of Bacterial Outer Membrane Permeability Revisited. In: Microbiol. Mol. Biol. Rev. Bd. 67, S. 593-656. PMID 14665678
Kategorien:- Porenbildendes Protein
- Proteingruppe
- Zellbiologie
Wikimedia Foundation.