- Postspinaler Kopfschmerz
-
Klassifikation nach ICD-10 G97.- Krankheiten des Nervensystems nach medizinischen Maßnahmen, anderenorts nicht klassifiziert G97.0 Austritt von Liquor cerebrospinalis nach Lumbalpunktion ICD-10 online (WHO-Version 2006) Der postpunktionelle Kopfschmerz (PPKS), auch als postspinaler oder postduraler Kopfschmerz, Kopfschmerz nach Duraperforation, Liquorunterdrucksyndrom oder in der internationalen Fachsprache als post-dural puncture headache (PDPH) bezeichnet, ist eine Nebenwirkung nach diagnostischen, therapeutischen oder versehentlichen Punktionen des Hirnwasserraums im Bereich des Rückenmarks.
Der Kopfschmerz tritt, stark von der eingesetzten Methode abhängig, in 0,5–70 % der Fälle auf und beginnt meist ab dem zweiten Tag nach der Punktion. Er kann von Übelkeit, Erbrechen, Schwindel und anderen Symptomen begleitet werden. Die Behandlung erfolgt primär konservativ durch Bettruhe, ausreichende Flüssigkeitszufuhr und Schmerzmedikation. Bei Erfolglosigkeit dieser Maßnahmen werden verschiedene invasive Therapieverfahren angewendet, als Mittel der Wahl gilt der epidurale Blutpatch, bei dem patienteneigenes Blut örtlich injiziert wird, das durch Gerinnung die Hirnhautperforation verschließt. Insgesamt ist die Prognose gut bis sehr gut, in Einzelfällen kann der Schmerz jedoch über einen längeren Zeitraum anhalten. Die wichtigste Maßnahme zur Prophylaxe eines postpunktionellen Kopfschmerzes ist die Verwendung von möglichst dünnen Punktionsnadeln mit atraumatischer Spitze.
Inhaltsverzeichnis
Ursachen und Pathogenese
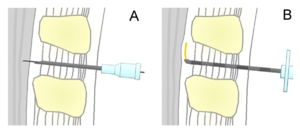
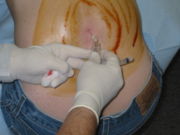
Der postpunktionelle Kopfschmerz kann nach einer diagnostischen Lumbalpunktion, wie sie in der Neurologie durchgeführt wird, oder einer Spinalanästhesie, einem Verfahren der Anästhesie, auftreten. Bei beiden werden mit einer speziellen Punktionskanüle in der Höhe der Lendenwirbelsäule die Haut, Bänder der Wirbelsäule sowie die harte Hirnhaut (Dura mater) und Spinnengewebshaut (Arachnoidea mater) durchstochen, um zu diagnostischen Zwecken Hirnwasser (Liquor cerebrospinalis) aus dem Hirnwasserraum (Subarachnoidalraum, Liquorraum) zu entnehmen (Lumbalpunktion), oder Narkosemittel einzuspritzen, um schmerzfreie Operationen der unteren Körperhälfte zu ermöglichen (Spinalanästhesie).
Unbeabsichtigt ist das Durchdringen der harten Hirnhaut bei der Durchführung einer Epiduralanästhesie (synonym Periduralanästhesie), bei der ein Katheter außerhalb der Hirnhaut platziert werden soll, um eine Schmerztherapie in diesem Bereich zu ermöglichen. Das Durchstoßen der Hirnhaut tritt bei diesem Verfahren als ungewollte Nebenwirkung auf.
Als Entstehungsmechanismus (Pathogenese) wird ein Liquorverlustsyndrom durch die Perforationstelle der harten Hirnhaut postuliert, wenngleich der Mechanismus nicht im Detail geklärt ist. Durch dieses Leck tritt der Liquor aus, wobei sich ein Unterdruck im Liquorraum (intrathekal) entwickelt, wenn der Verlust die Neubildungsrate übersteigt, die etwa 0,35 ml/Minute beträgt. Dieser Unterdruck des Liquorraumes, der sich anatomisch bis in den Schädel fortsetzt, hat dort eine Dehnung schmerzempfindlicher Strukturen (Hirnhäute, Gefäße, Falx cerebri), eine kompensatorische Gefäßweitstellung (Vasodilatation) und möglicherweise einen erhöhten Hirndruck durch einen behinderten venösen Abfluss der Gehirngefäße zur Folge. Diese Reaktionen bewirken in der Summe den Kopfschmerz.[1]
Epidemiologie
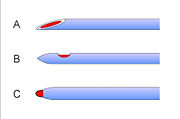
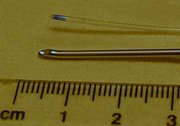
Die Häufigkeit des PPKS liegt heute im Rahmen der beabsichtigen Liquorpunktionen bei etwa 0,5–18 %, bei der versehentlichen Punktion bei der Epiduralanästhesie mit einer Tuohy-Nadel kann der Kopfschmerz bei bis zu 70 % der Fälle auftreten. Den größten Einfluss auf die Inzidenz hat dabei die Form und der Durchmesser der benutzen Punktionskanüle. Spinalnadeln mit größerem Durchmesser und schneidender, schräg angeschliffener Spitze (Quincke-Nadel) weisen höhere Raten von PPKS auf als dünne Nadeln, die atraumatisch (symmetrisch) angeschliffen sind (sogenannter Pencil-Point-Schliff, z. B. Whitacre-Nadel, Sprotte-Nadel).[2] Mit heutigen Standardnadeln (Durchmesser Gauge 27 bis 25 bis 22, atraumatisch geschliffen) beträgt die Kopfschmerzrate etwa 0,5 bis 1 bis 6 %.[1]
Ein postpunktioneller Kopfschmerz tritt im Rahmen einer diagnostischen Lumbalpunktion häufiger auf als nach Punktion bei einer Spinalanästhesie, da bei der diagnostischen Lumbalpunktion Kanülen mit einem größeren Durchmesser verwendet werden, um die benötigte Hirnwassermenge (>10 ml) zu gewinnen. Auch zur Messung des Liquordruckes werden Kanülen mit größerem Durchmesser benötigt.
Ein statistisch höheres Risiko, einen postpunktionellen Kopfschmerz zu erleiden, haben junge Patienten, Patientinnen in der Geburtshilfe und solche mit einem vormalig aufgetretenem Kopfschmerz nach Durapunktion.[1]
Symptome
Der Kopfschmerz ist am Hinterkopf (okzipital) und/oder der Stirn (frontal) betont und meist lageabhängig. Typisch ist eine Ausstrahlung in den Nacken. Im Liegen tritt eine Besserung, im Sitzen und Stehen sowie bei Kopfschütteln und erhöhtem Bauchdruck eine Verschlimmerung der Beschwerden auf. In den meisten Fällen tritt der Kopfschmerz nach 24–48 Stunden auf und hält im Mittel vier bis sechs Tage an. In der Regel bessert sich der Schmerz nach einigen Tagen, es kann jedoch auch eine Persistenz über mehrere Wochen und selten auch bis zu einem Jahr oder länger auftreten. Nicht nur die Häufigkeit, sondern auch Ausmaß und Dauer der Schmerzen sind von Art und Durchmesser der benutzten Kanüle abhängig. Die Kopfschmerzen sind in der Regel nach der Perforation bei einer Epiduralanästhesie wesentlich stärker ausgeprägt.
Begleitende Symptome können Übelkeit und Erbrechen, Schwindel, Nackensteifigkeit, Rückenschmerzen, Licht- und Geräuschempfindlichkeit, das Auftreten von Doppelbildern und Sehstörungen (durch Irritationen des dritten, vierten und sechsten Hirnnerven) sowie Hörstörungen oder Tinnitus (durch Irritationen des achten Hirnnerven) sein. Sehr selten treten generalisierte Krampfanfälle auf.
Komplikationen ergeben sich insbesondere aus der Bettlägerigkeit mit dem Auftreten von Beinvenenthrombosen und Folgeerkrankungen sowie der stark eingeschränkten Versorgungsfähigkeit des Patienten (erhöhter Pflegeaufwand, verlängerter Krankenhausaufenthalt, Unfähigkeit zur adäquaten Versorgung eines Neugeborenen).[1][3]
Diagnose
Die Diagnosestellung erfolgt primär nach klinischen Aspekten. Nach den Diagnosekriterien der International Headache Society ist der PPKS als Kopfschmerz definiert, der sich innerhalb von fünf Tagen nach einer Duraperforation einstellt, sich innerhalb von 15 Minuten nach Aufrichten verschlimmert und innerhalb von 15 Minuten nach Hinlegen bessert sowie eines der begleitenden Symptome Nackensteifigkeit, Tinnitus, Hörminderung (Hypakusis), Lichtscheue (Photophobie) oder Übelkeit aufweist. Er muss sich zudem spontan innerhalb einer Woche oder nach invasiver Therapie innerhalb von 48 Stunden zurückbilden.[4]
Differenzialdiagnostisch muss eine bakterielle Meningitis anhand klinischer Zeichen (Fieber, meningeale Reizzeichen) und im Zweifelsfall durch weiterführende Diagnostik (Erregernachweis durch erneute diagnostische Liquorentnahme, Magnetresonanztomografie-Aufnahmen) ausgeschlossen werden. Weitere mögliche Ursachen eines akut aufgetreten Kopfschmerzes sind eine aseptische Meningitis und Raumforderungen innerhalb der Schädelhöhle wie etwa Hirnblutungen.[1]
Therapie
Als therapeutische Möglichkeiten stehen neben der medikamentösen Behandlung begleitende konservative Maßnahmen und bei unzureichender Wirksamkeit invasive Therapieverfahren zur Verfügung.[5]
Konservative Maßnahmen
Die konservativen Behandlungsansätze stellen primär eine symptomorientierte Therapie dar, die den Schmerz lindern soll, bis sich das Duraleck eigenständig verschlossen hat. Eine reichliche (intravenöse oder perorale) Flüssigkeitszufuhr wird von vielen Autoren empfohlen, obwohl ein Nutzen nicht bewiesen ist, ebenso eine flache Lagerung, um den Liquordruck im Lendenwirbelbereich und damit den Flüssigkeitsverlust durch die Punktionsstelle zu reduzieren. Wichtig ist eine intensive Betreuung und Aufklärung über das Krankheitsbild und den Verlauf. In der Regel ist die Gabe von nichtsteroidalen Analgetika wie Acetylsalicylsäure, Paracetamol oder Metamizol ausreichend, um den Kopfschmerz zu lindern. Bei starken Schmerzen ist auch der Einsatz von Opioiden möglich, bei Übelkeit können ergänzend Antiemetika hilfreich sein. Bei Patienten, die aufgrund massiver Schmerzen nicht mobilisierbar sind, wird eine Thromboseprophylaxe mit Heparin durchgeführt. Durch diese Maßnahmen tritt bei der Mehrzahl der Patienten eine Besserung innerhalb weniger Tage ein.[1][3]
Eine Reihe von Substanzen wird mit dem Ziel einer spezifischen Therapie eingesetzt, um die Liquorproduktion zu steigern und die Gefäßweitstellung des Gehirns (zerebrale Vasodilatation) rückgängig zu machen. Die Datenlage zu diesen Wirkstoffen ist widersprüchlich und besteht oft aus Fallberichten und kleineren Studien, so dass Therapieempfehlungen nur eingeschränkt daraus abgeleitet werden können. Als möglicher Wirkmechanismus der Methylxanthin-Derivate Koffein und Theophyllin wird eine Verengung (Vasokonstriktion) der erweiterten Gehirngefäße, für Theophyllin auch eine erhöhte Liquorproduktion diskutiert. Es konnte teilweise eine signifikante Reduktion der Schmerzen gezeigt werden, weshalb die Anwendung von einigen Autoren empfohlen wird.[6] Diese Ergebnisse werden allerdings aus evidenzbasierter Sicht in Frage gestellt, zudem können als Nebenwirkungen Herzrhythmusstörungen und Krampfanfälle auftreten.[7] Der erfolgreiche Einsatz von Sumatriptan, einem Migränemedikament, das ebenfalls zu einer Gefäßverengung führt, ist in einzelnen Fallberichten beschrieben worden, während diese Erfolge in einer kontrollierten Studie nicht bestätigt werden konnten.[8] Auch der Einsatz von ACTH oder Desmopressin erscheint fraglich.[1][3]
Invasive Therapieverfahren
Bei schwer ausgeprägtem postspinalem Kopfschmerz, therapieresistentem Verlauf über 24 Stunden oder begleitenden neurologischen Symptomen sind invasive Maßnahmen indiziert. Mittel der Wahl ist dabei der epidurale Blutpatch (EBP), der 1960 erstmals beschrieben wurde. Zur Durchführung eines Blutpatches wird dem Patienten unter sterilen Bedingungen Blut entnommen. Mit einer Tuohy-Nadel, wird, wie im Rahmen einer Epiduralanästhesie, der Epiduralraum an der Höhe des Duralecks punktiert und 10-20 ml des Blutes injiziert. Durch dieses Volumen wird der Druck im Liquorraum erhöht, was oft zu einer sofortigen Besserung der Beschwerden führt. Im Verlauf wird durch das gerinnende Blut der Defekt der Dura verschlossen.[1] Bei einer initialen Erfolgsrate von über 90 % bleiben bei der Methode 70–90 % der Patienten auch dauerhaft beschwerdefrei, Wiederholungen bei ungenügendem Effekt führen fast immer zu einer bleibenden Besserung.[9]
Kommt die epidurale Eigenblutinjektion aufgrund von Gegenanzeigen (Ablehnung, verminderte Gerinnung, lokale Infektionen, Sepsis) nicht in Frage, stehen Alternativen zur Verfügung, deren Effektivität allerdings weit weniger gut untersucht ist und die deshalb nicht als Routineverfahren eingesetzt werden. Die epidurale Injektion von kristalloiden oder kolloidalen Infusionslösungen zeigt eine gute initiale Wirksamkeit, ist oft jedoch nicht von Dauer. Unklar ist zudem, ob durch Kolloide (Dextrane) Nervenschäden verursacht werden können. Der Einsatz von Fibrinkleber auf dieselbe Weise befindet sich im experimentellen Stadium. Die Datenlage über epidural oder intrathekal injizierte Opioide ist nicht eindeutig.[1][3]
Bei therapieresistentem Liquorverlust ist nach Ausschöpfung der bestehenden Möglichkeiten letztendlich ein operativer Verschluss des Duralecks notwendig.
Prophylaxe
Die Verwendung von möglichst dünnen Nadeln mit atraumatischem Schliff ist die wichtigste Maßnahme, um die Rate an postspinalem Kopfschmerz im Rahmen einer Spinalanästhesie oder Lumbalpunktion zu senken.[2] Es wird vermutet, dass der Grund für diese klinischen Beobachtungen darin liegt, dass durch eine atraumatische Spitze die Fasern der Dura mater auseinandergedrängt werden und sich der Defekt durch die Elastizität im Anschluss wieder verkleinert. Möglicherweise spielen auch die unregelmäßiger ausgeprägten Ränder der Leckage eine Rolle, die zu einer Entzündungsreaktion mit Ödembildung und so zu einer Abdichtung des Defektes führen.[10] Bei abnehmendem Durchmesser der Kanülen steigt allerdings die Versagerquote der Verfahren und das Risiko von technischen Nebenwirkungen (Nadelverbiegung, Nadelbruch), so dass die benutzten Nadelstärken (Gauge 27 bis 22) ein Kompromiss sind. Obwohl die Anordnung der Fasern der Dura mater nicht – wie früher angenommen – parallel zur Körperlängsachse verläuft, bewirkt eine senkrechte Ausrichtung des Schliffes beim Einsatz schneidender Nadeln eine verminderte Rate an postspinalem Kopfschmerz. Die Gründe dafür sind unklar.[1]
Bei der Durchführung einer Epiduralanästhesie ist das Kanülendesign nur von geringer Bedeutung, da in der Regel mit einer Tuohy-Kanüle punktiert wird. Bei der Widerstandsverlustmethode wird Kochsalzlösung statt Luft empfohlen; die Nadel soll hierbei nicht rotiert werden. Wird versehentlich der Liquorraum punktiert, kann eine einmalige Injektion von Kochsalzlösung in diesen die Kopfschmerzrate vermindern. Ein dort eingelegter Katheter kann für 24 Stunden belassen werden, wodurch sich ebenfalls ein günstiger Effekt ergibt.[1]
Weitere prophylaktische Faktoren zur Verminderung der Kopfschmerzrate mit nachgewiesener Wirkung sind die Vermeidung mehrfacher Punktionen und die Durchführung durch einen erfahrenen Arzt. Präventive Bettruhe im Anschluss an eines der betreffenden Verfahren hat hingegen keine Auswirkung auf die Inzidenz des postspinalen Kopfschmerzens und ist nicht angezeigt.[11][12]
Historische Aspekte
Das Syndrom wurde schon bei einer der Erstbeschreibungen der Spinalanästhesie durch den Chirurgen August Bier 1899 erwähnt.[13] Sein Assistent August Hildebrand, mit dem Bier im gegenseitigen Versuch Spinalanästhesien durchgeführt hatte, entwickelte im Anschluss einen stark ausgeprägten Kopfschmerz mit Übelkeit.[14]
Im frühen 20. Jahrhundert, als die Spinalanästhesie sich im klinischen Alltag etablierte, entwickelten aufgrund der ausschließlich zur Verfügung stehenden schneidenden Nadeln bis zu 50 % der Patienten einen postpunktionellen Kopfschmerz. Diese Rate ließ sich erst mit der Einführung der Pencilpoint-Spitze durch Whitacre und Hart (1951)[15] signifikant reduzieren.[3]
Belege
Literatur
- R. Rossaint, C. Werner, B. Zwißler: Die Anästhesiologie: Allgemeine und spezielle Anästhesiologie, Schmerztherapie und Intensivmedizin. Springer, 2. Auflage 2008. ISBN 978-3-540-76301-7
- P. Kessler, H. Wulf: Duraperforation - postpunktioneller Kopfschmerz - Prophylaxe- und Therapiemöglichkeiten. Anästhesiol Intensivmed Notfallmed Schmerzther 2008;43:346-353 PMID 18464211 (Abstract)
- Diagnostik und Therapie des Liquorunterdruck-Syndroms. Leitlinien für Diagnostik und Therapie in der Neurologie; 3. Auflage 2005, Georg Thieme Verlag Stuttgart. ISBN 3-13-132413-9
- Turnbull DK, Shepherd DB: Post-dural puncture headache: pathogenesis, prevention and treatment. Br J Anaesth. 2003 Nov;91(5):718-29. PMID 14570796
Einzelnachweise
- ↑ a b c d e f g h i j k Kessler und Wulf, 2008 (siehe Lit.)
- ↑ a b Halpern S, Preston R: Postdural puncture headache and spinal needle design. Metaanalyses. Anesthesiology. 1994 Dec;81(6):1376-83. PMID 7992906
- ↑ a b c d e Turnbull und Shepherd, 2003 (siehe Lit.)
- ↑ International Headache Society: Zweite Ausgabe der Internationalen Kopfschmerz-Klassifikation (ICHD-2): Postpunktioneller Kopfschmerz
- ↑ Zoys TS: An overview of postdural puncture headaches and their treatment. In: ASRA Supplement of the American Society of Regional Anesthesia (1996)
- ↑ Diagnostik und Therapie des Liquorunterdruck-Syndroms. Leitlinie der Deutschen Gesellschaft für Neurologie, 2005 (siehe Lit.)
- ↑ Halker RB et al: Caffeine for the prevention and treatment of postdural puncture headache: debunking the myth. Neurologist. 2007 Sep;13(5):323-7. PMID 17848873
- ↑ Connelly NR, Parker RK, Rahimi A, Gibson CS: Sumatriptan in patients with postdural puncture headache. Headache. 2000 Apr;40(4):316-9. PMID 10759937
- ↑ Duffy PJ, Crosby ET: The epidural blood patch. Resolving the controversies. Can J Anaesth. 1999 Sep;46(9):878-86. PMID 10490158
- ↑ Reina MA at al: An in vitro study of dural lesions produced by 25-gauge Quincke and Whitacre needles evaluated by scanning electron microscopy. Reg Anesth Pain Med. 2000 Jul-Aug;25(4):393-402. PMID 10925937
- ↑ Sudlow C, Warlow C: Posture and fluids for preventing post-dural puncture headache. Cochrane Database Syst Rev. 2002;(2):CD001790. PMID 12076420
- ↑ Thoennissen J, Herkner H, Lang W, Domanovits H, Laggner AN, Mullner M: Does bed rest after cervical or lumbar puncture prevent headache? A systematic review and meta-analysis. CMAJ 2001;165:1311–16 PMID 11760976
- ↑ Bier A: Versuche über Cocainisierung des Rückenmarkes. Deutsche Zeitschrift für Chirurgie 1899;51:361–9
- ↑ P. Oehme: Rückenmarksanästhesie mit Kokain: Die Prioritätskontroverse zur Lumbalanästhesie. Dtsch Arztebl 1998;95(41):A-2556-8
- ↑ Hart JR, Whitacre RJ: Pencil-point needle in prevention of postspinal headache. J Am Med Assoc. 1951 Oct 13;147(7):657-8. PMID 14873528
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Postduraler Kopfschmerz — Klassifikation nach ICD 10 G97. Krankheiten des Nervensystems nach medizinischen Maßnahmen, anderenorts nicht klassifiziert G97.0 Austritt von Liquor cerebrospinalis nach Lumbalpunktion … Deutsch Wikipedia
Postpunktioneller Kopfschmerz — Klassifikation nach ICD 10 G97. Krankheiten des Nervensystems nach medizinischen Maßnahmen, anderenorts nicht klassifiziert G97.0 Austritt von Liquor cerebrospinalis nach Lumbalpunk … Deutsch Wikipedia
Barbotage — Eine Spinalanästhesie (lat. spinalis, zur Wirbelsäule/Rückenmark gehörig; griech. an „nicht“ und αἴσθησις /aisthesis/ „Wahrnehmung“; Synonym: Lumbalanästhesie nach lat. lumbus, Lende) ist eine rückenmarknahe Form der Regionalanästhesie. Durch die … Deutsch Wikipedia
Lumbalanästhesie — Eine Spinalanästhesie (lat. spinalis, zur Wirbelsäule/Rückenmark gehörig; griech. an „nicht“ und αἴσθησις /aisthesis/ „Wahrnehmung“; Synonym: Lumbalanästhesie nach lat. lumbus, Lende) ist eine rückenmarknahe Form der Regionalanästhesie. Durch die … Deutsch Wikipedia
Sakralblock — Eine Spinalanästhesie (lat. spinalis, zur Wirbelsäule/Rückenmark gehörig; griech. an „nicht“ und αἴσθησις /aisthesis/ „Wahrnehmung“; Synonym: Lumbalanästhesie nach lat. lumbus, Lende) ist eine rückenmarknahe Form der Regionalanästhesie. Durch die … Deutsch Wikipedia
Sattelblock — Eine Spinalanästhesie (lat. spinalis, zur Wirbelsäule/Rückenmark gehörig; griech. an „nicht“ und αἴσθησις /aisthesis/ „Wahrnehmung“; Synonym: Lumbalanästhesie nach lat. lumbus, Lende) ist eine rückenmarknahe Form der Regionalanästhesie. Durch die … Deutsch Wikipedia
Transiente neurologische Symptome — Eine Spinalanästhesie (lat. spinalis, zur Wirbelsäule/Rückenmark gehörig; griech. an „nicht“ und αἴσθησις /aisthesis/ „Wahrnehmung“; Synonym: Lumbalanästhesie nach lat. lumbus, Lende) ist eine rückenmarknahe Form der Regionalanästhesie. Durch die … Deutsch Wikipedia
Spinalanästhesie — Eine Spinalanästhesie (lat. spinalis, zur Wirbelsäule/Rückenmark gehörig; griech. an „nicht“ und αἴσθησις /aisthesis/ „Wahrnehmung“; Synonym: Lumbalanästhesie nach lat. lumbus, Lende) ist eine rückenmarknahe Form der Regionalanästhesie. Durch die … Deutsch Wikipedia
Spinalnadel — Eine Spinalkanüle ist eine spezielle Hohlnadel (Kanüle), mit der aus dem Wirbelsäulenkanal (Spinalkanal) Nervenwasser (Liquor cerebrospinalis) entnommen wird oder durch die Medikamente in den Liquor injiziert werden (siehe auch Lumbalpunktion,… … Deutsch Wikipedia
Spinalkanüle — Spinalnadeln vom Typ Quincke Eine Spinalkanüle ist eine spezielle Hohlnadel (Kanüle), mit der aus dem Wirbelsäulenkanal (Spinalkanal) Nervenwasser (Liquor cerebrospinalis) entnommen wird oder durch die Medikamente in den Liquor injiziert werden… … Deutsch Wikipedia