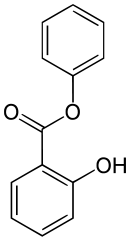
- Salicylat
-
Strukturformel 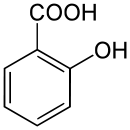
Allgemeines Name Salicylsäure Andere Namen - 2-Hydroxybenzencarbonsäure (IUPAC)
- 2-Hydroxybenzoesäure
- ortho-Hydroxybenzoesäure
- o-Hydroxybenzoesäure
- Spirsäure
- Spiroylsäure
Summenformel C7H6O3 CAS-Nummer 69-72-7 PubChem 338 ATC-Code DrugBank DB00936 Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse 138,12 g·mol−1 Aggregatzustand fest
Dichte 1,443 g·cm−3 [1]
Schmelzpunkt Siedepunkt 211 °C (27 mbar) [1]
Dampfdruck 27 hPa (211 °C)
pKs-Wert - pKS1 = 2,97
- pKS2 = 13,74
Löslichkeit gut in Ethanol (49,6 g/100g bei 15°C [2], Ether und Aceton, nahezu nicht in kaltem Wasser (1,8 g/l bei 20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-41 S: 22-24-26-39 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Salicylsäure (o-Hydroxybenzoesäure) kommt in Form ihres Methylesters in ätherischen Ölen und als Pflanzenhormon in den Blättern, Blüten und Wurzeln verschiedener Pflanzen vor und ist für die pflanzliche Abwehr von Pathogenen von Bedeutung. Ihren Namen bekam sie, da sie früher vor allem durch die oxidative Aufbereitung von Salicin, das in der Rinde verschiedener Weiden (wissenschaftlich Salix spec.) enthalten ist, gewonnen wurde.
Sie ist auch unter dem Namen Spirsäure bekannt, da sie aus dem Saft der Spirstaude (botanisch: früher Spiraea ulmaria, heute Filipendula ulmaria, deutsch: Mädesüß, einer mehrjährigen, krautigen Pflanze aus der Familie der Rosengewächse (Rosaceae), die vorwiegend auf Nasswiesen wächst) gewonnen werden kann. Von der Bezeichnung Spirsäure leitet sich auch der Markenname Aspirin® für die Acetylsalicylsäure ab: Acetylspirsäure. Die Salze der Salicylsäure werden als Salicylate bezeichnet.
Inhaltsverzeichnis
Chemische Klassifizierung
Die Salicylsäure zählt aufgrund des enthaltenen Benzolrings zu den Aromaten. Da sie eine Carboxyl- und Hydroxylgruppe enthält, gehört sie zu den Hydroxycarbonsäuren. Wegen der β-Ständigkeit der Carboxyl- zur Hydroxylgruppe kann sie auch als β-Hydroxycarbonsäure bezeichnet werden. Da die Hydroxylgruppe direkt an den aromatischen Benzolring gebunden ist, gehört sie ebenfalls zu den Phenolen.
Darstellung und Gewinnung
Technisch wird sie durch die Kolbe-Schmitt-Reaktion (vereinfacht auch als Salicylsäure-Synthese bezeichnet) aus Kohlenstoffdioxid und Natriumphenolat hergestellt. Diese künstliche Herstellung hat die Gewinnung aus Weidenrinde weitestgehend verdrängt.
Eigenschaften und Verwendung
Bei schnellem, starkem Erhitzen decarboxyliert Salicylsäure unter Bildung von Phenol.
Die - im Vergleich zu anderen Hydroxybenzoesäuren - hohe Acidität liegt an der Stabilisierung ihres Anions durch eine Wasserstoffbrücke mit der benachbarten Hydroxygruppe.
Salicylsäure dient zur Herstellung von Farb- und Riechstoffen und der Acetylsalicylsäure (ASS, besser bekannt unter dem Markennamen Aspirin®), die als schmerzstillendes und entzündungshemmendes Medikament Verwendung findet. In Form des unlöslichen Salzes Bismutsubsalicylat wird sie gegen Durchfall und Störungen des Gastrointestinaltraktes eingesetzt.
Salicylsäure hat auch eine antimikrobielle Wirkung[9], ihr Einsatz als Konservierungsmittel in Lebensmitteln ist allerdings verboten. In bis zu 2%iger Konzentration ist sie häufiger Bestandteil von Kosmetika.[10]
Ab 5%iger Lösung zeigt Salicylsäure einen für die Aknetherapie ausreichenden kerato- und somit auch komedolytischen Effekt.[10] In 10%iger Lösung wird sie zur Behandlung von Hühneraugen und Warzen eingesetzt.
Nachweis
Salicylsäure stellt formal das Enol (in diesem Fall ein Phenol) einer β-Ketocarbonsäure dar und bildet daher mit Eisen(III)-chlorid-Lösung einen violett gefärbten Komplex, den Tris-Salicylat-Eisen(III)-Komplex:
Dieser Nachweis ist nicht spezifisch, da ähnliche Verbindungen wie Acetessigester die gleiche Reaktion aufweisen.
Unerwünschte Wirkungen und Toxizität
Auf der Haut, für Schleimhäute und Augen wirkt Salicylsäure akut reizend bis gewebsschädigend. Weiterhin verursacht die Säure bei oraler oder sonstiger Einnahme eine Dämpfung des Atemzentrums und eine Störung wichtiger Stoffwechselprozesse sowie des Zentralnervensystems. Bei chronischer Einwirkung zeigen sich Störungen des Magen-Darm-Trakts.[1]
Die Salicylsäure ist das Wirkprinzip vieler analgetischer Medikamente wie der Acetylsalicylsäure. Diese werden im Organismus rasch zur Salicylsäure hydrolysiert. Nebenwirkungen sind vor allem allergische Reaktionen, Blutungsneigung, Bronchokonstriktionen (Asthma bronchiale), Magenschleimhautschädigung mit Blutungen, in Einzelfällen Leberschädigung. Auch Harnsäureretention, Hyperurikämie und Nierenschädigung wurden beobachtet.[11]
Im Tierversuch zeigte Salicylsäure bei oraler und dermaler Gabe verschiedenste Wirkungen auf Tiere (Katze, Maus, Kaninchen und Ratte) wie Schläfrigkeit, Muskelschwäche und Organschäden bei Leber und Nieren. Die akute Toxizität LD50 lag oral zwischen 400 und 1300 mg/kg, dermal bei der Ratte bei 2 g/kg.[3][4][5][6]
Beim Menschen wurden bei dermaler Verabreichung TDLo-Werte von 57 bis 111 mg/kg ermittelt.[7][8]
Ester der Salicylsäure
Reagiert Salicylsäure mit einem Alkohol, so entsteht unter Wasserabspaltung ein Carbonsäureester bzw. ein Salicylsäureester. Sie kann auch mit organischen Säuren Ester bilden, wobei sie dann in der Reaktion als Alkohol fungiert. Salicylsäureester werden hauptsächlich in der Kosmetik- und Parfumindustrie als Antirheumatika in Badezusätzen, Salben oder Cremes, sowie als Riechstoffe und als UV-Filter in Sonnenschutzmitteln verwandt. Der wohl bekannteste Ester der Salicylsäure ist die Acetylsalicylsäure. Hier wurde die Hydroxylgruppe der Salicylsäure mit der Carboxylgruppe der Essigsäure verestert.
Salicylsäurebenzylester
Salicylsäurebenzylester oder auch Benzylsalicylat ist eine viskose Flüssigkeit, die einen angenehmen Geruch besitzt und in Wasser wenig, in Alkohol und Ether leicht löslich ist. Er wird aus dem ätherischen Öl der Landnelke (Dianthus caryophyllus) isoliert und als Stabilisator für Parfums und in Sonnenschutzmitteln verwandt.
Chemische Daten:
- Summenformel: C14H12O3
- Molare Masse: 228,25 g·mol−1
- CAS-Nummer: 118-58-1
- Schmelzpunkt: 24 °C; Siedepunkt: 211 °C
Salicylsäureisobutylester
Salicylsäureisobutylester oder auch Isobutylsalicylat ist eine farblose Flüssigkeit, die nach Klee riecht und nicht in Wasser und Glycerin, dafür in Ethanol und Mineralölen löslich ist.
Chemische Daten:
- Summenformel: C11H14O3
- Molare Masse: 194,22 g·mol−1
- CAS-Nummer: 87-19-4
- Schmelzpunkt: 6 °C; Siedepunkt: 262 °C
Salicylsäureisopentylester
Salicylsäureisopentylester oder auch Isoamylsalicylat ist eine farblose Flüssigkeit, die nach Orchideen riecht und in Wasser unlöslich, aber mischbar mit Chloroform, Ethanol und Ether ist.
Chemische Daten:
- Summenformel: C12H16O3
- Molare Masse: 208,25 g·mol−1
- CAS-Nummer: 87-20-7
- Schmelzpunkt: ?; Siedepunkt: 274–278 °C
Salicylsäurephenylester
Salicylsäurephenylester oder auch Phenylsalicylat ist ein farbloses, kristallines Pulver, das einen schwach aromatischen Geruch besitzt und nur sehr wenig in Wasser, mehr jedoch in Benzol, Chloroform, Ethanol und Ether löslich ist. Er hat eine antiseptische und antirheumatische Wirkung und findet auch als UV-Schutz für die Haut und für Kunststoffe Verwendung.
Chemische Daten:
- Summenformel: C13H10O3
- Molare Masse: 214,21 g·mol−1
- CAS-Nummer: 118-55-8
- Schmelzpunkt: 41–43 °C; Siedepunkt: 173 °C
Weitere Salicylsäureester
- Methylsalicylat (Salicylsäuremethylester)
- Hydroxyethylsalicylat (Salicylsäurehydroxyethylester)
Quellen
- ↑ a b c d e f Eintrag zu Salicylsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 5. Januar 2008 (JavaScript erforderlich)
- ↑ Claudia Synowietz und Klaus Schäfer (Hrsg.): Chemiker Kalender. 3. Auflage. Spinger, Berlin Heidelberg New York Tokyo 1984, ISBN 3-540-12652-X.
- ↑ a b c Handbook of Toxicology 4 Vols., Philadelphia, W.B. Saunders Co., 1956-59, Vol. 5, Pg. 148, 1959.
- ↑ a b Drugs in Japan Vol. 6, Pg. 291, 1982.
- ↑ a b BIOFAX. Industrial Bio-Test Laboratories Inc., Data Sheets. Vol. 21-3/1971
- ↑ a b Acute Toxicity Data. Journal of the American College of Toxicology, Part B. Vol. 15 (Suppl.)
- ↑ a b Soyka, PA. und Soyka, LF. (1980): Absorption of salicylic acid. In: Journal of the American Medical Association (JAMA) 244(7); 660–661; PMID 7392165; PDF (freier Volltextzugriff, engl.)
- ↑ a b Dwyer, CM. et al (1994): Poisoning from topical salicylic acid. In:Postgraduate Medical Journal. 70(820); S. 146, PMID 8170891; PDF (freier Volltextzugriff, engl.)
- ↑ Hartmann, AA. (1990): The influence of various factors on the human resident skin flora. In: Semin Dermatol. 9(4): 305–308. PMID 2285575
- ↑ a b Fanta, Messeritsch-Fanta, Steyr: Akne 1999: brauchen wir den Hautarzt noch?. In: Der Hautarzt 12/1999; S. 900-911; Springer-Verlag. Vorschau und Volltext
- ↑ A. W. Frahm, H. H. J. Hager, F. v. Bruchhausen, M. Albinus, H. Hager: Hagers Handbuch der pharmazeutischen Praxis: Folgeband 4: Stoffe A-K.Birkhäuser, 1999, S. 42, ISBN 9783540526889
Siehe auch
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.