- Salicylaldehyd
-
Strukturformel 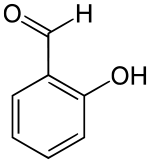
Allgemeines Name Salicylaldehyd Andere Namen - 2-Hydroxybenzaldehyd
- 2-Formylphenol
Summenformel C7H6O2 CAS-Nummer 90-02-8 PubChem 6998 Kurzbeschreibung farblose bis gelbliche Flüssigkeit mit bittermandelartigem Geruch und brennendem Geschmack[1]
Eigenschaften Molare Masse 122,13 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt Siedepunkt 197 °C[2]
Dampfdruck pKs-Wert 6,79[4]
Löslichkeit - schlecht in Wasser (14 g·l−1 bei 20 °C)[2]
- mischbar mit Ethanol und Diethylether[1]
Brechungsindex 1,5734[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: 262 [3] EU-Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 21/22-36/38-68 S: 26-36/37 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Salicylaldehyd ist eine natürlich in einigen Pflanzen und Insekten vorkommende chemische Verbindung, die heute vielfach als Duftstoff und in der pharmazeutischen und chemischen Industrie Verwendung findet. Salicylaldehyd gehört zur Gruppe der aromatischen Aldehyde.
Inhaltsverzeichnis
Geschichte
Ungefähr um 1838 gelang es dem Schweizer Apotheker und Pharmazeuten Johann Pagenstecher, aus den Blüten von Mädesüß Salicylaldehyd zu gewinnen, was dann einer der Ausgangspunkte zur Entdeckung des Schmerzmittels Acetylsalicylsäure (ASS) wurde.[6]
Vorkommen
Insekten (Blattkäfer) produzieren diese Verbindung in speziellen Drüsen gegen Fraßfeinde aus dem Salicin ihrer Wirtspflanzen. Es kommt weiterhin in der Sumpf-Spierstaude oder Mädesüß (Filipendula ulmaria, früher: Spiraea ulmaria) vor.
Gewinnung und Darstellung
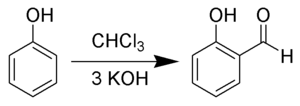
Früher wurde Salicylaldehyd durch Reimer-Tiemann-Reaktion (1876, frühe Carbenchemie) gewonnen.[7] Dabei werden Chloroform, Kaliumhydroxid und Phenol als Ausgangsstoffe benutzt. Heute wird als Verbesserung eine Phasen-Transfer-Katalyse verwendet.
Verwendung
Salicylaldehyd dient als Zwischenprodukt in der Farbstoff- und Arzneimittelindustrie sowie in 10%iger alkoholischer Lösung zum Nachweis von Ketonen (z. B. Aceton im Harn) und von Fuselölen im Alkohol. Außerdem wird er zur Herstellung von Cumarin (Perkin-Reaktion) und von Schiffschen Basen, z. B. dem Komplexbildner N, N'-Bis-(salicyliden)-ethylendiamin (Abkürzung: salen), dessen Cobalt(II)-komplex (Salcomin) reversibel Sauerstoff binden kann, benutzt. Weiterhin wird es als Duftstoff in Parfüms eingesetzt.
Sicherheitshinweise
Salicylaldehyd ist ein Kontaktallergen.[8]
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e Eintrag zu CAS-Nr. 90-02-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Juni 2009 (JavaScript erforderlich).
- ↑ a b c Datenblatt Salicylaldehyd bei Merck, abgerufen am 22. April 2011.
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Salicylaldehyd bei ChemIDplus.
- ↑ C. Exner, H. Dapper: Die Weide lieferte Salicylsäure. Der Mensch machte Aspirin. Ein Medikament wird hundert Jahre alt.
- ↑ P. Rademacher: Organische Chemie IV.
- ↑ Informationen zu Kontaktallergenen – Salicylaldehyd.
Literatur
- Edwin A. Robinson: "The reaction of dichloromethylene with water and with phenoxide ions (Reimer–Tiemann reaction)", in: J. Chem. Soc., 1961, S. 1663–1671; doi:10.1039/JR9610001663.
- K. Winterfeld: Praktikum der organisch-präparativen Pharmazeutischen Chemie. 6. Auflage, Steinkopff.
Siehe auch
Wikimedia Foundation.