- Schwefelmonoxid
-
Summenformel Oxidationszahl Strukturformel S7O2 < +I 
S2O +I 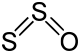
SO +II 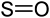
S2O2 +II 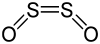
SO2 +IV 
SO3 +VI 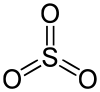
SO4 +VI 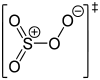
Als Schwefeloxide (allgemeine Formel SxOy) bezeichnet man die Oxide des chemischen Elements Schwefel.
Da Schwefel unterschiedliche Oxidationszahlen annehmen kann, gibt es mehrere verschiedene Schwefeloxide.
Schwefeloxide entstehen insbesondere bei der Verbrennung von Schwefel oder schwefelhaltigen Brennstoffen (Kohle, Benzin, Heizöl, Dieselkraftstoff), aber auch aufgrund von natürlichen Vorgängen bei Vulkanausbrüchen.
Schwefel bildet bei Verbrennungsvorgängen vor allem zwei Oxide:
- Schwefeldioxid, SO2 und
- Schwefeltrioxid, SO3 (in geringeren Mengen)
Beide Schwefeloxide bilden in wässriger Lösung Säuren. Aus Schwefeldioxid entsteht so die schweflige Säure, aus Schwefeltrioxid die Schwefelsäure. Beide Säuren spielen u. a. bei der Versauerung von Seen und beim Waldsterben eine Rolle. Beide Schwefeloxide sind auch als Gas giftig.
Im Rahmen des Bundes-Immissionschutzgesetzes und seiner Folgevorschriften sowie analoger Umweltgesetze wird der Begriff Schwefeloxid als Summenparameter für beide Schwefeloxide benutzt, die Angabe erfolgt als Äquivalent zum Schwefeldioxid.
Weitere Schwefeloxide sind Polyschwefelmonooxide SnO (mit n = 5–10). Diese sind Suboxide, bei denen das Schwefelatom eine Oxidationszahl niedriger als +I hat. Darüber hinaus gibt es auch noch Polyschwefelperoxide (SO3–4)n, die Oxidationszahl des Schwefels beträgt +VI.
Literatur
- Steudel, R. (2003): Sulfur-Rich Oxides SnO and SnO2 (n>1). In: Top. Curr. Chem. 231; 203–230; doi:10.1007/b13185
- Wong, MW. (2007): Structures and vibrational spectra of the sulfur-rich oxides SnO (n = 4–9): the importance of π*-π* interactions. In: Chemistry 13(2); 502–14; PMID 17013961
Siehe auch
Wikimedia Foundation.
