- Schwerer Wasserstoff
-
Strukturformel D–D Allgemeines Name Deuterium Andere Namen - Schwerer Wasserstoff
- Diplogen (veraltet)
Summenformel D2 (molekulare Form) CAS-Nummer 7782-39-0 PubChem 24523 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 4,028204 g·mol−1 Aggregatzustand gasförmig
Dichte 0,168 kg·m−3[1]
Schmelzpunkt Siedepunkt −249,58 °C[2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Hoch-
entzündlich(F+) R- und S-Sätze R: 12 S: (2)-9-16-33 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Deuterium (von griechisch δεύτερος, deúteros = „der Zweite“) ist neben Protium und Tritium ein Isotop des Wasserstoffs. Deuterium wird aufgrund seiner Masse auch als „Schwerer Wasserstoff“ bezeichnet. Sein Atomkern wird auch Deuteron genannt.
Eigenständige Namen für Isotope eines Elements gibt es nur bei Deuterium und Tritium, weil das Massenverhältnis zwischen Protium und seinen Isotopen verhältnismäßig groß ist (Deuterium 1:2 und Tritium 1:3) und sich daraus merkliche Unterschiede im chemischen Verhalten ergeben. (Zum Vergleich: Bei dem nächst größeren Isotopenpaar 3He und 4He sind es 1:1,33; bei 235U und 238U nur noch 1:1,013).
Inhaltsverzeichnis
Beschreibung
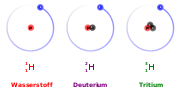 Wasserstoff (Protium), Deuterium, Tritium
Wasserstoff (Protium), Deuterium, TritiumDas chemische Symbol ist 2H; aus Gründen der Vereinfachung in der Formelschreibweise wird häufig auch D verwendet.
Im Gegensatz zum 1H-Wasserstoff, bei dem der Atomkern aus einem einzigen Proton besteht, besteht der Deuteriumkern aus einem Proton und einem Neutron. Der Anteil an Deuterium in natürlich vorkommendem Wasserstoff beträgt 0,015 %. Da keine Prozesse der stellaren Nukleosynthese bekannt sind, die Deuterium erzeugen, geht man davon aus, dass es alleine in der primordialen Nukleosynthese unmittelbar nach dem Urknall entstanden ist. Deshalb ist die Häufigkeit des Deuteriums im Kosmos ein wichtiger Parameter für kosmologische Modelle.
Wie normaler Wasserstoff kommt Deuterium nur in gebundener Form vor. Im einfachsten Fall verbinden sich zwei Deuterium-Atome zu einem Deuterium-Molekül. Dabei gibt es je nach Gesamtspin IG des Moleküls zwei Varianten, das Orthodeuterium (o-D2), wenn das Kernspinisomer den Gesamtspin 0 oder 2 besitzt, und das Paradeuterium (p-D2) im Falle IG = 1.
Gewinnung
Deuterium lässt sich aufgrund des relativ großen Massenunterschieds leichter anreichern als die Isotope der schweren Elemente wie z. B. Uran. In den ersten Anreicherungsstufen kommt gewöhnlich der Girdler-Sulfid-Prozess zum Einsatz. Dabei wird ausgenutzt, dass in einer wässrigen Schwefelwasserstoff-Lösung beide Molekülarten Wasserstoff austauschen können. Bei niedrigen Temperaturen wandert das Deuterium bevorzugt zum Wasser, bei hohen Temperaturen ist es umgekehrt. In der letzten Anreicherungsstufe wird das Gemisch aus H2O, HDO und D2O durch Destillation getrennt.
Anwendungen
Eingesetzt wird Deuterium als Moderator in Kernreaktoren (hier in Form von schwerem Wasser), als Brennstoff in Wasserstoffbomben, als Lösungsmittel in der 1H-NMR-Spektroskopie und als Tracer in der Chemie und Biologie.
Außerdem soll in zukünftigen Fusionsreaktoren ein Gemisch aus Deuterium und Tritium als Brennstoff verwendet werden.
Deuterium wurde 1931 von Harold Clayton Urey entdeckt, wofür er 1934 den Chemienobelpreis erhielt.
Schweres Wasser
Ersetzt man beim Wasser (H2O) den Wasserstoff durch Deuterium, so erhält man Schweres Wasser (D2O). Wird der Wasserstoff nur zur Hälfte durch Deuterium ersetzt, erhält man halbschweres Wasser (HDO).
Die Dichte von D2O beträgt 1,1047 g·cm−3 bei 25 °C, Der Schmelzpunkt liegt bei 3,8 °C und der Siedepunkt bei 101,4 °C. Das Dichtemaximum liegt bei 11,2 °C (Wasser: 3,98 °C). Dieser Unterschied in physikalischen Eigenschaften wird als der Isotopeneffekt bezeichnet. Er ist nirgends so stark ausgeprägt wie bei dem Paar 1H–2H.
Schweres Wasser ist in größerer Konzentration aus folgenden Gründen giftig:
- Es besitzt verminderte Lösefähigkeit im Vergleich zu normalem Wasser.
- Deuteronen haben ein geringeres Tunnelvermögen als Protonen und erschweren daher in biologischen Systemen die Aufrechterhaltung der elektrochemischen Gradienten an mitochondrialen Membranen. Diese sind aber ausschlaggebend für die Synthese von ATP.
- Die Funktionsfähigkeit der meisten Proteine hängt von der Beweglichkeit der umgebenden Wassermoleküle ab. Da Deuteronen wegen der größeren Masse träger sind, können die Proteine ihre Aufgaben nur schlechter oder überhaupt nicht mehr erfüllen.
Sicherheitshinweise
Deuterium ist in der Richtlinie 67/548/EWG nicht aufgeführt, ist aber in dieser Beziehung wie Wasserstoff zu betrachten, denn alle Isotope eines Elementes verhalten sich bezüglich ihrer chemischen Gefährlichkeit gleich.
Verwendung in der Popkultur
Der Begriff Deuterium taucht häufig in der Science-Fiction auf, wenn es um futuristische Energieträger geht. Im Browserspiel OGame ist es beispielsweise eine förderbare Ressource, in der TV-Serie Star Trek wird Deuterium als Standardtreibstoff für Raumschiffe genutzt. Hierbei handelt es sich jedoch nicht um Fiktion, Deuterium ermöglicht die Kernfusion bei wesentlich gemäßigteren Bedingungen als Wasserstoff und ist deswegen namensgebender Bestandteil von Wasserstoffbomben und zumindest rein theoretisch auch ein geeigneter Treibstoff für Raumschiffe mit Fusionsantrieb.
Einzelnachweise
- ↑ Air Liquide - Deuterium – Unser Gas.
- ↑ a b http://www.roempp.com RÖMPP online
- ↑ Eintrag zu CAS-Nr. 1333-74-0 im European chemical Substances Information System ESIS
Siehe auch
Wikimedia Foundation.
