- Wasserstoff
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Wasserstoff, H, 1 Serie Nichtmetalle Gruppe, Periode, Block 1, 1, s Aussehen farbloses Gas CAS-Nummer 1333-74-0 Massenanteil an der Erdhülle 0,88 %[1] Atomar [2] Atommasse 1,008 (1,00784–1,00811)[3] u Atomradius (berechnet) 25 (53) pm Kovalenter Radius 31 pm Van-der-Waals-Radius 120 pm Elektronenkonfiguration 1s1 1. Ionisierungsenergie 1312 kJ/mol Physikalisch [2] Aggregatzustand gasförmig Dichte 0,0899 kg · m−3 [4] bei 273 K Magnetismus diamagnetisch (χm = −2,2 · 10−9)[5] Schmelzpunkt 14,01 K (-259,14 °C) Siedepunkt 20,28 K (-252,87 °C) Molares Volumen (fest) 11,42 · 10−6 m3/mol Verdampfungswärme 0,90[6] kJ/mol Schmelzwärme 0,558 kJ/mol Schallgeschwindigkeit 1270 m/s bei 298,15 K Spezifische Wärmekapazität 14304 J/(kg · K) Wärmeleitfähigkeit 0,1805 W/(m · K) Chemisch [2] Oxidationszustände +1, 0, −1 Oxide (Basizität) H2O, H2O2 (amphoter) Normalpotential 0 V Elektronegativität 2,2 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE (MeV) ZP 1H 99,9885(70) %
Stabil 2H (D) 0,0115(70) %
Stabil 3H (T) 10−15 %
12,33 a β− 0,019 3He Weitere Isotope siehe Liste der Isotope NMR-Eigenschaften Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [7] 

Gefahr
H- und P-Sätze H: 220-280 EUH: keine EUH-Sätze P: 210-377-381-403 [4] Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [7] 
Hoch-
entzündlich(F+) R- und S-Sätze R: 12 S: (2)-9-16-33 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Wasserstoff ist ein chemisches Element mit dem Symbol H (für lateinisch hydrogenium „Wassererzeuger“; von altgriechisch ὕδωρ hydōr „Wasser“ und γίγνομαι gignomai „werden, entstehen“) und der Ordnungszahl 1. Im Periodensystem steht es in der 1. Periode und der 1. Gruppe, nimmt also den ersten Platz ein.
Wasserstoff ist das häufigste chemische Element im Universum, jedoch nicht in der Erdrinde. Er ist Bestandteil des Wassers und beinah aller organischen Verbindungen. Somit kommt gebundener Wasserstoff auch in sämtlichen lebenden Organismen vor.
Wasserstoff ist das leichteste der chemischen Elemente. Das häufigste Isotop enthält kein Neutron, besteht aus nur einem Proton sowie einem Elektron und wird auch Protium genannt. Unter Bedingungen, die normalerweise auf der Erde herrschen (siehe auch Normalbedingungen), kommt dieser atomare Wasserstoff nicht vor, stattdessen liegt Wasserstoff in der dimerisierten Form vor, dem molekularen Wasserstoff H2, einem farb- und geruchlosen Gas. Dennoch kommt es vor, dass bei bestimmten chemischen Reaktionen Wasserstoff sehr kurz atomar als H, bezeichnet als Status nascendi, auftritt und in dieser hochreaktiven Form besonders gut mit anderen Verbindungen oder Elementen reagiert.
Geschichte
Entdeckt wurde Wasserstoff vom englischen Chemiker und Physiker Henry Cavendish im Jahre 1766, als er mit Metallen (Eisen, Zink und Zinn) und Säuren experimentierte. Cavendish nannte das dabei entstandene Gas wegen seiner Brennbarkeit "inflammable air". Er untersuchte das Gas eingehend und veröffentlichte seine Erkenntnisse darüber noch im selben Jahr.[8]
Eine genauere Analyse geschah durch Antoine Laurent de Lavoisier, der dem Wasserstoff auch seinen Namen gab. Der französische Chemiker entdeckte das Gas im Jahr 1787 unabhängig von Cavendish, als er in einem Experiment zeigen wollte, dass bei chemischen Reaktionen keine Masse verloren geht oder erzeugt wird. Er leitete Wasserdampf in einer abgeschlossenen Apparatur über glühende Eisenspäne und ließ ihn an anderer Stelle kondensieren. Dabei stellte er fest, dass die Masse des kondensierten Wassers etwas geringer war als die der ursprünglichen Menge. Dafür entstand ein Gas, dessen Masse zusammen mit dem Gewichtszuwachs des oxidierten Eisens genau der „verlorengegangenen“ Wassermenge entsprach. Sein eigentliches Experiment war also erfolgreich.
Lavoisier untersuchte das entstandene Gas weiter und führte die heute als Knallgasprobe bekannte Untersuchung durch, wobei das Gas verbrannte. Er nannte es daher zunächst „brennbare Luft“. Als er in weiteren Experimenten zeigte, dass sich aus dem Gas umgekehrt auch Wasser erzeugen lässt, taufte er es hydro-gène (griechisch: hydro = Wasser; genes = erzeugend). Das Wort bedeutet demnach: „Wasserbildner“. Die deutsche Bezeichnung lässt auf die gleiche Begriffsherkunft schließen.
Vorkommen
Wasserstoff ist das häufigste chemische Element in der Sonne und den großen Gasplaneten Jupiter, Saturn, Uranus und Neptun, die über 99,99 % der Masse des Sonnensystems in sich vereinen. Wasserstoff stellt 75 % der gesamten Masse beziehungsweise 93 % aller Atome des Sonnensystems. Im gesamten Weltall wird (unter Nichtbeachtung dunkler Materie) ein noch höherer Anteil an Wasserstoff vermutet.
Vorkommen im Universum
Schon kurz nach der Entstehung des Universums waren Protonen und Neutronen in überwältigender Zahl vorhanden. Bei den vorherrschenden hohen Temperaturen vereinigten sich diese zu leichten Atomkernen, wie 2H und 4He. Die meisten Protonen blieben allerdings unverändert und stellten die zukünftigen 1H-Kerne dar. Nach ungefähr 380.000 Jahren war die Strahlungsdichte des Universums so gering geworden, dass sich Wasserstoff-Atome einfach durch Zusammenschluss der Kerne mit den Elektronen bilden konnten ohne gleich wieder durch ein Photon auseinander gerissen zu werden.
Mit der weitergehenden Abkühlung des Universums formten sich unter dem Einfluss der Gravitation und ausgehend von räumlichen Dichteschwankungen allmählich Wolken aus Wasserstoffgas, die sich zunächst großräumig zu Galaxien und darin zu Protosternen zusammenballten. Unter dem wachsenden Druck der Schwerkraft setzte schließlich die Kernfusion ein, bei der Wasserstoff zu Helium verschmilzt. So entstanden erste Sterne und auch die Sonne.
Sterne bestehen weit überwiegend aus Wasserstoff-Plasma. Die Kernfusion von Wasserstoff 1H erfolgt hauptsächlich über die Zwischenstufen Deuterium 2H und Tritium 3H zu Helium 4He. Die dabei frei werdende Energie ist die Energiequelle der Sterne. Der in unserer Sonne enthaltene Wasserstoff macht den größten Teil der gesamten Masse unseres Sonnensystems aus.
Aber auch die schweren Gasplaneten bestehen zu großen Teilen aus Wasserstoff, was den Massenanteil des Elements im Sonnensystem weiter erhöht. Unter den extremen Drücken, die in großen Tiefen in den großen Gasplaneten Jupiter und Saturn herrschen, kann er in metallischer Form existieren. Dieser Zustand ist wegen der elektrischen Leitfähigkeit vermutlich für die Ausbildung der planetaren Magnetfelder verantwortlich.
Außerhalb unseres Sonnensystems kommt Wasserstoff auch in gigantischen Gaswolken vor. In den so genannten H-I-Gebieten liegt das Element nichtionisiert und molekular vor. Diese Gebiete emittieren Strahlung von etwa 1420 MHz, die sogenannte 21-cm-Linie, auch HI- oder Wasserstofflinie genannt, die von Übergängen des Gesamtdrehimpulses herrührt. Sie spielt eine wichtige Rolle in der Astronomie und dient dazu, Wasserstoffvorkommen im All zu lokalisieren und zu untersuchen.
Ionisierte Gaswolken mit atomarem Wasserstoff nennt man dagegen H-II-Gebiete. In diesen Gebieten strahlen große Sterne hohe Mengen ionisierende Strahlung ab. Mit ihrer Hilfe lassen sich Rückschlüsse auf die Zusammensetzung der interstellaren Materie ziehen. Wegen ständiger Ionisation und Rekombination der Atome senden sie mitunter sichtbare Strahlung aus, die oft so stark ist, dass man diese Gaswolken mit einem relativ kleinen Fernrohr sehen kann.
Irdische Vorkommen
Auf der Erde ist der Massenanteil wesentlich geringer. Bezogen auf die Erd-Gesamtmasse bestehen etwa 0,12 % und bezogen auf die Erdkruste etwa 2,9 % aus Wasserstoff. Außerdem liegt der irdische Wasserstoff im Gegensatz zu den Vorkommen im All überwiegend gebunden und nur selten in reiner Form als unvermischtes Gas vor. Die bekannteste und am häufigsten auftretende Verbindung ist das Wasser. Neben diesem sind auch Erdgase wie z. B. Methan sowie das Erdöl wichtige wasserstoffhaltige Verbindungen auf der Erde. Auch in mehr als der Hälfte aller bisher bekannten Minerale ist Wasserstoff enthalten.[9]
Der größte Anteil irdischen Wasserstoffs kommt in der Verbindung Wasser vor. In dieser Form bedeckt er über zwei Drittel der Erdoberfläche. Die gesamten Wasservorkommen der Erde belaufen sich auf circa 1,386 Milliarden km3. Davon entfallen 1,338 Milliarden km3 (96,5 %) auf Salzwasser in den Ozeanen. Die verbliebenen 3,5 % liegen als Süßwasser vor. Davon befindet sich wiederum der größte Teil im festen Aggregatzustand: in Form von Eis in der Arktis und Antarktis sowie in den Permafrostböden vor allem in Sibirien. Der geringe restliche Anteil ist flüssiges Süßwasser und findet sich meist in Seen und Flüssen, aber auch in unterirdischen Vorkommen, etwa als Grundwasser.
In der Erdatmosphäre liegt Wasserstoff hauptsächlich chemisch gebunden in Form von Wasserdampf vor. Dessen Anteil an der Luft schwankt stark und liegt bei bis zu über 4 Volumenprozent. Er wird als relative Luftfeuchtigkeit gemessen. Diese gibt den Anteil an Wasserdampf im Verhältnis zum temperaturabhängigen Sättigungsdampfdruck an. Beispielsweise entsprechen bei 30 °C Lufttemperatur 100 % Luftfeuchtigkeit 4,2 Volumenprozent Wasserdampf in der Luft.
Die Häufigkeit von molekularem Wasserstoff in der Atmosphäre beträgt nur 0,55 ppm. Dieser niedrige Anteil kann mit der hohen thermischen Geschwindigkeit der Moleküle und dem hohen Anteil an Sauerstoff in der Atmosphäre erklärt werden. Bei der mittleren Temperatur der Atmosphäre bewegen sich die H2-Teilchen im Durchschnitt mit fast 7.000 km/h. Das ist rund ein Sechstel der Fluchtgeschwindigkeit auf der Erde. Aufgrund der Maxwell-Boltzmann-Verteilung der Geschwindigkeiten der H2-Moleküle gibt es aber dennoch eine beträchtliche Zahl von Molekülen, welche die Fluchtgeschwindigkeit trotzdem erreichen. Die Moleküle haben jedoch nur eine extrem geringe freie Weglänge, sodass nur Moleküle in den oberen Schichten der Atmosphäre tatsächlich entweichen. Weitere H2-Moleküle kommen aus darunter liegenden Schichten nach, und es entweicht wieder ein bestimmter Anteil, bis letztlich nur noch Spuren des Elements in der Atmosphäre vorhanden sind. Zudem wird der Wasserstoff in den unteren Schichten der Atmosphäre durch eine photoaktivierte Reaktion mit Sauerstoff zu Wasser verbrannt. Bei einem geringen Anteil stellt sich ein Gleichgewicht zwischen Verbrauch und Neuproduktion (durch Bakterien und photonische Spaltung des Wassers) ein.
Gewinnung
Molekularer Wasserstoff
Einfache chemische Prozesse zur Produktion von H2 sind die Reaktion verdünnter Säuren mit unedlen Metallen (z. B. Zink) oder die Zersetzung des Wassers durch Alkalimetalle. Diese, im chemischen Laboratorium für kleine Mengen üblichen Methoden, sind aber für die industrielle Herstellung ungeeignet und unwirtschaftlich.
Eine Methode zur industriellen Gewinnung von molekularem Wasserstoff ist die Dampfreformierung. Unter hoher Temperatur und hohem Druck werden Kohlenwasserstoffe mit Wasser umgesetzt. Dabei entsteht Synthesegas, ein Gemisch aus Kohlenstoffmonoxid und Wasserstoff. Das Mengenverhältnis kann dann durch die sogenannte Wassergas-Shift-Reaktion eingestellt werden. Diese Methode wird hauptsächlich für industrielle Hochdrucksynthesen eingesetzt. Die zweite gängige Methode in der Industrie ist die partielle Oxidation. Hierbei reagiert meistens Erdgas mit Sauerstoff unter Bildung von H2 und Kohlenmonoxid.
Eine alte und effiziente Möglichkeit zur Wasserstoffgewinnung ist die Elektrolyse von Wasser. Dabei wird Wasser mit Hilfe von elektrischem Strom in Wasserstoff und Sauerstoff gespalten.

- Wasser wird durch elektrischen Strom in Wasserstoff und Sauerstoff gespalten.
Meist wird dem Wasser ein wenig Säure zur Katalyse der Reaktion zugesetzt. An der Kathode entsteht Wasserstoffgas, an der Anode Sauerstoffgas, im Mol- und Volumenverhältnis 2:1.
Diese Methode wird heute allerdings nur noch in sehr geringem Umfang eingesetzt, vor allem zur Gewinnung von „schwerem Wasser“, das sich bei der Elektrolyse im nicht umgesetzten Rest anreichert.
Eine sehr moderne Methode ist das Kværner-Verfahren. Dabei zerlegt ein Plasmabrenner Kohlenwasserstoffe zu Kohlenstoff und Wasserstoff und erreicht dabei enorm hohe Wirkungsgrade. Ein anderes modernes Verfahren bedient sich der Grünalgen. Hier kommen biologische Prozesse zum Einsatz. Die benötigte Energie entnehmen die Algen einfach dem Sonnenlicht. Das Verfahren ist also sehr ökologisch. Allerdings verursacht der Unterhalt der Algen hohe Kosten und ist somit wenig ökonomisch und wird deshalb kaum angewendet.
Forscher am Leibniz-Institut für Katalyse in Rostock stellten 2011 einen neuen Katalysator vor, mit dessen Hilfe sich Bioalkohol zur Wasserstoffgewinnung nutzen lässt. Der Katalysator auf Basis eines Ruthenium-Komplexes zeigt eine bisher unerreicht hohe Effizienz bei der Erzeugung von Wasserstoff aus Alkoholen unter milden Reaktionsbedingungen bei Temperaturen zwischen 60 und 80 °C, wobei die Umsatzrate im Vergleich zu bisherigen Katalysatorsystemen um fast eine Zehnerpotenz höher liegt.[10]
Atomarer Wasserstoff
Atomarer Wasserstoff kann durch Zufuhr der Dissoziationsenergie aus dem molekularen Element erzeugt werden. Methodisch wird dieses bewerkstelligt durch Erhitzung auf mehrere tausend Grad, elektrische Entladung bei hoher Stromdichte und niedrigem Druck, Bestrahlung mit Ultraviolettlicht, Beschuss mit Elektronen bei 10 bis 20 Elektronenvolt oder Mikrowellenstrahlung. Allerdings reagiert atomarer Wasserstoff sehr schnell wieder zu molekularem Wasserstoff. Es stellt sich somit ein Fließgleichgewicht ein, das in der Regel weit auf der Seite des molekularen Wasserstoffs liegt.
 [11]
[11]- Durch Energiezufuhr dissoziiert molekularer Wasserstoff in die atomare Form.
Zur Darstellung von größeren Mengen atomaren Wasserstoffs sind das Woodsche Darstellungsverfahren (Robert Williams Wood, 1898) und dasjenige von Irving Langmuir besonders geeignet.
Physikalische Eigenschaften
 Wasserstoff in einer Entladungsröhre
Wasserstoff in einer Entladungsröhre
Wasserstoff ist das Element mit der geringsten Dichte. Molekularer Wasserstoff (H2, ein Molekül besteht also jeweils aus 2 Wasserstoffatomen) ist etwa 14,4-mal leichter als Luft. Sein Siedepunkt liegt bei 20,27 Kelvin, der Schmelzpunkt bei 14,02 Kelvin (−259 °C). Die Löslichkeit von Wasserstoff in Wasser beträgt 1,6 mg/l.
Einige thermodynamische Eigenschaften (Transportphänomene) sind aufgrund der geringen Molekülmasse und der daraus resultierenden hohen mittleren Geschwindigkeit der Wasserstoffmoleküle (1770 m/s bei 25 °C) von besonderer Bedeutung, (wie z. B. beim Oberth-Effekt- Raketentreibstoff). Wasserstoff besitzt bei Raumtemperatur das höchste Diffusionsvermögen, die höchste Wärmeleitfähigkeit und die höchste Effusionsgeschwindigkeit aller Gase. Eine geringere Viskosität weisen nur drei- oder mehratomige reale Gase wie zum Beispiel n-Butan auf.
Die Mobilität des Wasserstoffs in einer festen Matrix ist, bedingt durch den geringen Molekülquerschnitt, ebenfalls sehr hoch. So diffundiert Wasserstoff durch Materialien wie Polyethylen und glühendes Quarzglas. Ein sehr wichtiges Phänomen ist die außerordentlich hohe Diffusionsgeschwindigkeit in Eisen, Platin und einigen anderen Übergangsmetallen, da es dort dann zur Wasserstoffversprödung kommt. In Kombination mit einer hohen Löslichkeit treten bei einigen Werkstoffen extrem hohe Permeationsraten auf. Hieraus ergeben sich technische Nutzungen zur Wasserstoffanreicherung, aber auch technische Probleme beim Transportieren, Lagern und Verarbeiten von Wasserstoff und Wasserstoffgemischen, da nur Wasserstoff diese räumlichen Begrenzungen durchwandert (siehe Sicherheitshinweise).
 Sichtbarer Bereich des Wasserstoff-Spektrums. Es sind sechs Linien der Balmer-Serie sichtbar, da die CCD-Sensoren der Kamera auch ein wenig in den ultravioletten Teil des Spektrums hinein empfänglich sind.
Sichtbarer Bereich des Wasserstoff-Spektrums. Es sind sechs Linien der Balmer-Serie sichtbar, da die CCD-Sensoren der Kamera auch ein wenig in den ultravioletten Teil des Spektrums hinein empfänglich sind.
Wasserstoff hat ein Linienspektrum und je nach Temperatur des Gases auch im sichtbaren Bereich ein mehr oder weniger ausgeprägtes kontinuierliches Spektrum. Letzteres ist beim Sonnenspektrum besonders ausgeprägt. Die ersten Spektrallinien im sichtbaren Bereich, zusammengefasst in der so genannten Balmer-Serie, liegen bei 656 nm, 486 nm, 434 nm und 410 nm. Daneben gibt es weitere Serien von Spektrallinien im Infrarot- (Paschen-Serie, Brackett-Serie und Pfund-Serie) und eine im Ultraviolettbereich (Lyman-Serie) des elektromagnetischen Spektrums. Eine besondere Bedeutung in der Radioastronomie hat die 21-Zentimeter-Linie in der Hyperfeinstruktur.
In einem magnetischen Feld verhält sich H2 sehr schwach diamagnetisch. Das bedeutet, die Dichte der Feldlinien eines extern angelegten Magnetfeldes nimmt in der Probe ab. Die magnetische Suszeptibilität ist bei Normdruck χm = −2,2 · 10−9 und typischerweise einige Größenordnungen unter der von diamagnetischen Festkörpern.
Gegenüber elektrischem Strom ist H2 ein Isolator. In einem elektrischen Feld hat er eine Durchschlagsfestigkeit von mehreren Millionen Volt pro Meter.
Aggregatzustände
Bei Temperaturen unterhalb von 20,27 Kelvin kondensiert Wasserstoff zu einer klaren, farblosen Flüssigkeit. Dieser Zustand wird auch als LH2 abgekürzt (engl. liquid, „flüssig“). Senkt man die Temperatur weiter, dann geht Wasserstoff bei 14,02 Kelvin (−259,2 °C) in einen schlammartigen Zustand, genannt Slush über, bevor er gefriert und einen kristallinen Festkörper mit hexagonal dichtester Kugelpackung (hcp) bildet, wobei jedes Molekül von zwölf weiteren umgeben ist.
Anders als bei Helium tritt beim Verflüssigen von einfachem Wasserstoff ( 1H) keine Suprafluidität auf; prinzipiell kann aber das Isotop Deuterium ( 2H) suprafluid werden.
Der Tripelpunkt des Wasserstoffs, bei dem seine drei Aggregatzustände gleichzeitig vorkommen, ist einer der Fixpunkte der Internationalen Temperaturskala. Er liegt bei einer Temperatur von exakt 13,8033 Kelvin[12] und einem Druck von 7,042 kPa[12]. Der kritische Punkt liegt bei 33,18 K[12] und 13,0 bar[12], die kritische Dichte beträgt 0,03136 g/cm3 (die niedrigste kritische Dichte aller Elemente)[13].
Unter extremen Drücken, wie sie innerhalb von Gasplaneten herrschen, wird wahrscheinlich metallischer Wasserstoff, d. h. in metallischer Form, ausgebildet. Dabei wird er elektrisch leitend (vgl. Leiterbahn).
Atom- und kernphysikalische Eigenschaften
Ein einzelnes Wasserstoffatom besteht aus einem positiv geladenen Kern und einem negativ geladenen Elektron, das über die Coulomb-Wechselwirkung an den Kern gebunden ist. Dieser besteht stets aus einem einzelnen Proton (1H-Isotop) und je nach Isotop aus einem oder zwei zusätzlichen Neutronen (2H bzw. 3H-Isotop). Das Wasserstoffatom 1H wird aufgrund seines einfachen Aufbaus als „Modellatom“ in der physikalischen Beschreibung der Atome herangezogen.
So entstand aus Untersuchungsergebnissen am Wasserstoff das Bohrsche Atommodell, mit dessen Hilfe eine vergleichsweise einfache Beschreibung vieler Eigenschaften des Wasserstoffatoms möglich ist. Man stellt sich dazu vor, dass das Elektron den Kern auf einer bestimmten konzentrischen, kugelförmigen Kreisbahn umläuft. Nach Bohr kann das Elektron auch auf andere, im Abstand zum Kern genau definierte Bahnen springen, so auch auf weiter außen liegende, wenn ihm die dazu nötige Energie zugeführt wird (z. B. durch Erhitzen). Beim Rücksprung von einer äußeren auf eine innere Bahn wird jeweils eine elektromagnetische Strahlung oder Welle einer bestimmten, der frei werdenden Energie entsprechende Wellenlänge abgegeben. Mit diesem Modell lassen sich die Spektrallinien des H-Atoms erklären, die im sichtbaren Licht bei Wellenlängen von 656 nm, 486 nm, 434 nm und 410 nm liegen (Balmer-Serie); im ultravioletten Bereich liegt die Lyman-Serie mit Wellenlängen von 122 nm, 103 nm, 97 nm und 95 nm. Wichtige Serien im Infraroten sind die Paschen-Serie (1,9 µm; 1,3 µm; 1,1 µm und 1 µm) und die Brackett-Serie (4,1 µm; 2,6 µm; 2,2 µm und 1,9 µm) (in allen Serien sind hier nur die ersten vier Linien angegeben). Das Bohrsche Modell reicht aber bei der Betrachtung von Details und für andere Atome zur Erklärung der dabei beobachteten bzw. gemessenen Phänomene nicht aus.
Physikalisch korrekter ist die quantenmechanische Beschreibung. Das H-Atom ist das einzige, für das sich das Eigenwertproblem sowohl der nichtrelativistischen Schrödingergleichung als auch der relativistischen Diracgleichung analytisch, das heißt ohne den Einsatz numerischer Verfahren, lösen lässt. Das ist sonst nur für Ionen möglich, denen lediglich ein Elektron verblieben ist (beispielsweise He+, Li2+, usw.).
Andere quantenmechanische Phänomene bewirken weitere Effekte. Die Feinstruktur der Spektrallinien kommt u. a. daher, dass Bahndrehimpuls und Spin des Elektrons miteinander koppeln. Berücksichtigt man darüber hinaus auch den Kernspin, kommt man zur Hyperfeinstruktur. Eine sehr kleine, aber physikalisch besonders interessante Korrektur durch Vakuumfluktuationen ist die Lambverschiebung. Durch all diese Korrekturen wird bereits das Spektrum des Wasserstoffs zu einem komplexen Phänomen, dessen Verständnis im Rahmen der Quantenmechanik viel theoretisches Wissen erfordert.
Kernspinzustände im H2-Molekül
Unter normalen Bedingungen ist Wasserstoffgas H2 ein Gemisch zweier Molekülzustände, die sich durch die „Richtung“ ihrer Kernspins unterscheiden. Diese beiden Formen werden als ortho- und para-Wasserstoff bezeichnet (kurz o- und p-Wasserstoff). Bei o-Wasserstoff haben die Kernspins die gleiche (parallele) Richtung, während sie beim p-Wasserstoff entgegengesetzte (antiparallele) Richtung aufweisen. o-Wasserstoff ist die energiereichere Form. Die beiden Molekülzustände hängen über folgende, temperaturabhängige Gleichgewichtsbeziehung miteinander zusammen:

- Die beiden Formen können unter Energieaufnahme bzw. -abgabe ineinander übergehen.
Am absoluten Nullpunkt findet man ausschließlich p-Wasserstoff. Unter Standardbedingungen liegen 25 % des Wasserstoffs als p-Form und 75 % als o-Form vor. Theoretische Berechnungen ergeben, dass der Anteil der o-Form nicht über diesen Anteil hinaus gesteigert werden kann. Die physikalischen Eigenschaften von o- und p-Wasserstoff sind geringfügig verschieden. So liegen beispielsweise der Schmelz- und Siedepunkt der p-Form etwa 0,1 K unter denen der o-Form.
Bei der industriellen Herstellung von flüssigem Wasserstoff spielt die Übergangsbedingung zwischen o- und p-Wasserstoff eine wichtige Rolle. Der Wechsel der Kerne in die antiparallele Orientierung (p-Wasserstoff) erfolgt beim Abkühlen nur sehr langsam, da die Wechselwirkungen zwischen den Kernen – genauer gesagt beeinflussen sich die Kerne über ihre magnetischen Momente – nur sehr schwach sind. Deswegen versucht man, die Einstellung des Gleichgewichts durch den Einsatz von Katalysatoren zu beschleunigen.
Chemische Eigenschaften
Besonderheiten
Im Periodensystem steht Wasserstoff in der I. Hauptgruppe, weil er 1 Valenzelektron besitzt. Ähnlich wie die ebenfalls dort stehenden Alkalimetalle hat er in vielen Verbindungen die Oxidationszahl +1. Allerdings sitzt sein Valenzelektron auf der K-Schale, die nur maximal 2 Elektronen haben kann und somit die Edelgaskonfiguration bereits mit 2 Elektronen und nicht mit 8 wie die anderen Schalen erreicht.
Durch Aufnahme eines Elektrons kann er also die Edelgaskonfiguration des Heliums erreichen. Er hat dann die Oxidationszahl −1 und in Bindungen einen Halogencharakter. Diese Bindungen geht er mit sehr unedlen Metallen ein. Man spricht dann von einem Hydrid.
Diese Stellung quasi „in der Mitte“ zwischen Edelgaskonfigurationen, in der er die gleiche Anzahl Elektronen aufnehmen oder abgeben kann, ist eine Eigenschaft, die der IV. Hauptgruppe ähnelt, was auch seine Elektronegativität erklärt, die eher der des Kohlenstoffs als der des Lithiums gleicht.
Aufgrund dieser „gemäßigten“ Elektronegativität sind die für die I. Hauptgruppe typischen Bindungen des Wasserstoffs in der Oxidationszahl +1 keine Ionenbindungen wie bei den Alkalimetallen, sondern kovalente Molekülbindungen.
Zusammenfassend sind die Eigenschaften des Wasserstoffs für die I. Hauptgruppe atypisch, da aufgrund der Tatsache, dass die K-Schale nur 2 Elektronen aufnehmen kann, auch teilweise Eigenschaften anderer Gruppen hinzukommen.
Molekularer Wasserstoff
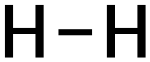 Lewisformel des Wasserstoffmoleküls
Lewisformel des Wasserstoffmoleküls
Bei Zündung reagiert Wasserstoff mit Sauerstoff und Chlor heftig, ist sonst aber vergleichsweise beständig und wenig reaktiv. Bei hohen Temperaturen wird das Gas reaktionsfreudig und geht mit Metallen und Nichtmetallen gleichermaßen Verbindungen ein.
Mit Chlor reagiert Wasserstoff exotherm unter Bildung von gasförmigem Chlorwasserstoff, der in Wasser gelöst Salzsäure ergibt. Beide Gase reagieren dabei mit gleichen Stoffmengenanteilen:

- je ein Chlor- und Wasserstoffmolekül reagieren zu zwei Chlorwasserstoffmolekülen
Diese Reaktion ist unter dem Namen Chlorknallgasreaktion bekannt, die sich schon durch die Bestrahlung mit Licht zünden lässt. Für die Knallgasreaktion (Wasserstoff und Sauerstoff) bedarf es einer Zündung

- je ein Sauerstoff- und zwei Wasserstoffmoleküle reagieren zu zwei Wassermolekülen
Die aggressivste Reaktion bei niedrigen Temperaturen geht jedoch Wasserstoff mit Fluor ein. Wird Wasserstoffgas bei −200 °C auf gefrorenes Fluor geleitet, reagieren die beiden Stoffe sofort explosiv miteinander.

- je ein Fluor- und Wasserstoffmolekül reagieren zu zwei Fluorwasserstoffmolekülen
Wird der molekulare Wasserstoff ionisiert, so spricht man vom Diwasserstoff-Kation. Dieses Teilchen tritt z.B. in niedertemperatur Plasmaentladungen in Wasserstoff als häufiges Ion auf.

- Ionisation durch ein schnelles Elektron im Plasma
Angeregter Wasserstoff
Wasserstoff im statu nascendi, d. h. im Zustand des Entstehens unmittelbar nach einer Wasserstoff erzeugenden Reaktion, existiert nur für Sekundenbruchteile. Innerhalb dieser Zeitspanne reagieren in der Regel zwei H-Atome miteinander. Aber auch nach diesem Zusammenschluss liegt der Wasserstoff für kurze Zeit in einem angeregten Zustand vor und kann so – abweichend vom „normalen“ chemischen Verhalten – für verschiedene Reaktionen genutzt werden, die mit molekularem Wasserstoff nicht möglich sind.
So gelingt es zum Beispiel nicht, mit Hilfe von im Kippschen Apparat erzeugtem Wasserstoffgas, in einer angesäuerten, violetten Kaliumpermanganatlösung (KMnO4) oder gelben Kaliumdichromatlösung (K2Cr2O7) den die Reduktion anzeigenden Farbwechsel hervorzurufen. Mit direkt in diesen Lösungen, durch Zugabe von Zinkpulver generiertem Wasserstoff in statu nascendi gelingt diese reduktive Farbänderung.

- Nascierender Wasserstoff vermag unter sauren Bedingungen violette Permanganatlösung zu entfärben.

- Unter sauren Bedingungen wird gelbe Dichromatlösung grün durch die reduktive Wirkung des nascierenden Wasserstoffs.
Atomarer Wasserstoff
Um molekularen Wasserstoff in die Atome zu zerlegen, muss Energie von etwa 4,5 eV pro Molekül oder genauer 436,22 kJ/mol aufgewendet werden (der Chemiker spricht von Enthalpie); beim Zusammenschluss zu Wasserstoffmolekülen (H2 ) wird diese Energie wieder freigesetzt:

- Zwei H-Atome reagieren zu einem H2-Molekül und setzen dabei Energie frei.
Das Gleichgewicht dieser Reaktion liegt unter Normalbedingungen vollkommen auf der rechten Seite der dargestellten Gleichung, denn atomarer Wasserstoff reagiert sehr rasch und stark exotherm zu molekularem Wasserstoff (oder mit anderen Reaktionspartnern, wenn solche in der Nähe sind).
Eine Anwendung findet diese Reaktion beim Arcatom-Schweißen.
Auch im Weltraum liegt bei niedrigen Temperaturen in der Regel molekularer Wasserstoff vor. In der Nähe heißer Sterne wird molekularer Wasserstoff jedoch von deren Strahlung aufgespalten, so dass dort die atomare Form überwiegt. Diese ist zwar sehr reaktiv und geht schnell neue Verbindungen ein, vor allem mit anderen Wasserstoffatomen, die jedoch von der Strahlung ebenfalls wieder gespalten werden. Siehe dazu auch H-II-Gebiet.
Anmerkung: Wasserstoff in den Sternen liegt nicht nur atomar vor, sondern auch als Plasma: Die Elektronen sind infolge der dort herrschenden hohen Temperaturen je nach Temperatur von den Protonen mehr oder weniger abgetrennt. Die Oberfläche der Sonne hat jedoch nur eine Temperatur von ungefähr 6000 °C. Bei dieser Temperatur ist immer noch der größte Teil des Wasserstoffes nicht ionisiert und sogar molekular, d. h. das Gleichgewicht liegt weit auf der Seite des molekularen Wasserstoffes. Die thermische Energie ist bei 6000 °C weit unter der Energie von 4,5 eV, die zur Auflösung der molekularen Bindung erforderlich ist. Die Sonne ist jedoch in der Korona mit mindestens einer Million Kelvin wesentlich heißer. Daher sind im Sonnenlicht die Übergänge der Elektronen im atomaren Wasserstoff erkennbar. Chemische Verbindungen können sich bei so hohen Temperaturen kaum bilden und zerfallen sofort.
Wasserstoffbrückenbindung
Eine wichtige Eigenschaft des Wasserstoffs ist die so genannte Wasserstoffbrückenbindung, eine anziehende elektrostatische Kraft zwischen zwei Molekülen. Ist H an ein stark elektronegatives Atom, wie zum Beispiel Fluor oder Sauerstoff, gebunden, so befindet sich sein Elektron eher in der Nähe des Bindungspartners. Es tritt also eine Ladungsverschiebung auf und das H-Atom wirkt nun positiv polarisiert. Der Bindungspartner wirkt entsprechend negativ. Kommen sich zwei solche Moleküle nahe genug, tritt eine anziehende elektrische Kraft zwischen dem positiven H-Atom des einen Moleküls und des negativen Teils des jeweiligen Partners auf. Das ist eine Wasserstoffbrückenbindung.
Da die Wasserstoffbrückenbindung mit nur 17 kJ/mol bis 167 kJ/mol[14] schwächer ist als die Bindungskraft innerhalb eines Moleküls, verbinden sich die Moleküle nicht dauerhaft. Vielmehr bleibt die Wasserstoffbrücke wegen ständiger Bewegung nur Bruchteile einer Sekunde bestehen. Dann lösen sich die Moleküle voneinander, um erneut eine Wasserstoffbrückenbindung mit einem anderen Molekül einzugehen. Dieser Vorgang wiederholt sich ständig.
Die Wasserstoffbrückenbindung ist für viele Eigenschaften verschiedener Verbindungen verantwortlich, wie etwa DNA oder Wasser. Bei Letzterem führen diese Bindungen zu den Anomalien des Wassers, insbesondere der Dichteanomalie.
Anmerkung: Die Wasserstoffbrückenbindung sollte nicht mit der Van-der-Waals-Bindung verwechselt werden, die auf ungleichmäßigen Ladungsverteilungen bei nichtpolaren Molekülen beruht und unter anderem für den Schmelz- oder Siedepunkt einen Stoffes verantwortlich ist.
Isotope
Es existieren drei natürlich vorkommende Isotope des Wasserstoffs. Von allen Elementen unterscheiden sich beim Wasserstoff – wenn auch nur geringfügig – die Isotope in ihren chemischen Reaktionsfähigkeiten am meisten. Das liegt an dem vergleichsweise großen Gewichtsunterschied (Deuterium doppelt, Tritium dreimal so schwer wie Wasserstoff). Dieser Unterschied beträgt schon bei den Isotopen des nächstschwereren Elements Helium nur noch 25 %. In jüngerer Zeit gelang es, die kurzzeitige Existenz von vier weiteren Kernen nachzuweisen (4H, 5H, 6H und 7H).[15] Diese Kerne haben aber alle eine sehr kurze Lebensdauer (< 10−21 s).
Isotop Name Symbol Eigenschaften 1H Protium H Das einfachste Wasserstoff-Isotop 1H besitzt keine Neutronen im Kern und wird gelegentlich Protium genannt. Es hat mit einer relativen Häufigkeit von 99,99 % den weitaus größten Anteil am irdisch vorkommenden Wasserstoff. Es ist nicht radioaktiv, also stabil. 2H Deuterium D Das Isotop 2H hat neben dem Proton ein Neutron im Kern. Man bezeichnet es als Deuterium. Für Deuterium gibt es das D als ein eigenes Elementsymbol. Verwendung findet es z. B. als Bestandteil von Lösungsmitteln für die 1H-NMR Spektroskopie, da es dabei kein störendes Nebensignal liefert. Es macht 0,0115 % aller Wasserstoffatome aus (nach IUPAC). Deuterium ist ebenfalls stabil. 3H Tritium T Tritium ist das dritte natürlich vorkommende Isotop des Wasserstoffs. Es hat aber nur einen verschwindenden Anteil am gesamten in der Natur vorkommenden Wasserstoff. Tritium besitzt zwei Neutronen und wird mit 3H oder T gekennzeichnet. Tritium ist radioaktiv und zerfällt durch Betazerfall (β−) mit einer Halbwertszeit von 12,32 Jahren in 3He. Tritium wird durch Kernreaktionen in der oberen Erdatmosphäre ständig als kosmogenes Radionuklid gebildet.[16] Bei einem Gleichgewicht von natürlicher Produktion und Zerfall ergibt sich, entsprechend der Quelle, ein Inventar von 3,5 kg auf der Erde. Tritium kann in Oberflächenwassern und in Lebewesen nachgewiesen werden. Durch Kernwaffentests ist die Konzentration des Tritiums in der Atmosphäre nach 1950 deutlich angestiegen. Exotische Isotope
Durch die Einbeziehung von Myonen, negativ geladenen instabilen Elementarteilchen mit ungefähr 10% der Masse eines Protons, können exotische kurzlebige Strukturen erstellt werden, die sich chemisch wie ein Wasserstoffatom verhalten.[17] Da Myonen selten natürlich vorkommen und ihre Lebensdauer lediglich 2 µs beträgt werden solche Wasserstoffisotope künstlich an Teilchenbeschleunigern hergestellt.
Das Myonium besteht aus einem Elektron und einem positiv geladenen Antimyon, das die Rolle des Protons (also des Atomkerns) einnimmt. Auf Grund seiner Kernladungszahl von 1 e handelt es sich bei Myonium chemisch um Wasserstoff. Wegen der geringen Atommasse von 0,1 u (1/10 von H) treten Isotopeneffekte bei chemischen Reaktionen besonders stark in Erscheinung, so dass damit Theorien für Reaktionsmechanismen gut überprüft werden können.[17]
Ein exotischer Wasserstoff mit einer Masse von 4,1 u entsteht, wenn in einem 4He-Atom eines der Elektronen durch ein Myon ersetzt wird. Auf Grund seiner gegenüber dem Elektron wesentlich höheren Masse ist das Myon dicht am He-Kern lokalisiert und schirmt eine der beiden Elementarladungen des Kerns ab. Zusammen bilden He-Kern und Myon effektiv einen Kern mit einer Masse von 4,1 u und einer Ladung von 1 e, so dass es sich chemisch um Wasserstoff handelt.[17]
Verwendung
Jedes Jahr werden weltweit mehr als 600 Milliarden Kubikmeter Wasserstoff (rd. 30 Mio. t) für zahllose Anwendungen in Industrie und Technik produziert. Wichtige Einsatzgebiete sind:
- Energieträger: Beim Schweißen, als Raketentreibstoff. Von seiner Verwendung als Kraftstoff für Strahltriebwerke, in Wasserstoffverbrennungsmotoren oder über Brennstoffzellen verspricht man sich, in absehbarer Zeit die Nutzung von Erdölprodukten ablösen zu können (siehe Wasserstoffantrieb), weil bei der Verbrennung nur Wasser entsteht und kein Kohlenstoffdioxid. Wasserstoff ist jedoch im Gegensatz zu Erdöl keine Primärenergie.
- Kohlehydrierung: Durch verschiedene chemische Reaktionen wird Kohle mit H2 in flüssige Kohlenwasserstoffe überführt. So lassen sich Benzin, Diesel und Heizöl künstlich herstellen.
- Momentan haben beide vorgenannten Verfahren wegen höherer Kosten noch keine wirtschaftliche Bedeutung. Das könnte sich aber drastisch ändern, sobald die Ölvorräte der Erde zur Neige gehen.
- Reduktionsmittel: H2 kann mit Metalloxiden reagieren und ihnen dabei den Sauerstoff entziehen. Es entsteht Wasser und das reduzierte Metall. Das Verfahren wird bei der Verhüttung von metallischen Erzen angewandt, insbesondere um Metalle möglichst rein zu gewinnen.
- Mit dem (Haber-Bosch-Verfahren) wird aus Stickstoff und Wasserstoff Ammoniak hergestellt und daraus wichtige Düngemittel und Sprengstoffe.
- Fetthärtung: Gehärtete Fette werden oft aus Pflanzenöl mittels Hydrierung gewonnen. Dabei werden die Doppelbindungen in den Fettsäure-Ketten der Fettmoleküle mit Wasserstoff abgesättigt. Die entstandenen Fette haben einen höheren Schmelzpunkt, wodurch das Produkt fest wird. Auf diese Weise stellt man Margarine her. Dabei können sich auch so genannte trans-Fettsäuren bilden.
- Lebensmittelzusatzstoff: Wasserstoff ist als E 949 zugelassen und wird als Treibgas, Packgas u.ä. verwendet.[18]
- Kühlmittel: Aufgrund seiner hohen Wärmekapazität benutzt man Wasserstoff in Kraftwerken und den dort eingesetzten Turbogeneratoren als Kühlmittel. Insbesondere setzt man H2 dort ein, wo eine Flüssigkeitskühlung problematisch werden kann. Die Wärmekapazität kommt dort zum Tragen, wo das Gas nicht oder nur langsam zirkulieren kann. Weil die Wärmeleitfähigkeit ebenfalls hoch ist, verwendet man strömendes H2 auch zum Abtransport von thermischer Energie in große Reservoire (z. B. Flüsse). In diesen Anwendungen schützt Wasserstoff die Anlagen vor Überhitzung und erhöht die Effizienz.
- Kryogen: Wegen der hohen Wärmekapazität eignet sich flüssiger Wasserstoff als Cryogen, also als Kühlmittel für extrem tiefe Temperaturen. Auch größere Wärmemengen können von flüssigem Wasserstoff gut absorbiert werden, bevor eine merkliche Erhöhung in seiner Temperatur auftritt. So wird die tiefe Temperatur auch bei äußeren Schwankungen aufrechterhalten.
- Traggas: In Ballons und Luftschiffen fand Wasserstoff eine seiner ersten Verwendungen. Wegen der leichten Entzündlichkeit von H2-Luft-Gemischen führte dies jedoch wiederholt zu Unfällen. Die größte Katastrophe in diesem Zusammenhang ist wohl das Unglück der „Dixmude“ 1923, am bekanntesten wurde sicherlich die „Hindenburg-Katastrophe“ im Jahr 1937. Wasserstoff als Traggas wurde mittlerweile durch Helium ersetzt und erfüllt diesen Zweck nur noch in sehr speziellen Anwendungen.
Die beiden natürlichen Isotope haben spezielle Einsatzgebiete.
Deuterium findet (in Form von schwerem Wasser) in Schwerwasserreaktoren als Moderator Verwendung, d. h. zum Abbremsen der bei der Kernspaltung entstehenden schnellen Neutronen auf thermische Geschwindigkeit.
Deuterierte Lösungsmittel werden in der magnetischen Kernresonanzspektroskopie benutzt, da Deuterium einen Kernspin von Eins besitzt und im NMR-Spektrum des normalen Wasserstoff-Isotops nicht sichtbar ist.
In der Chemie und Biologie helfen Deuteriumverbindungen bei der Untersuchung von Reaktionsabläufen und Stoffwechselwegen (Isotopenmarkierung), da sich Verbindungen mit Deuterium chemisch und biochemisch meist nahezu identisch verhalten wie die entsprechenden Verbindungen mit Wasserstoff. Die Reaktionen werden von der Markierung nicht gestört, der Verbleib des Deuteriums ist in den Endprodukten dennoch feststellbar.
Ferner sorgt der erhebliche Massenunterschied zwischen Wasserstoff und Deuterium für einen deutlichen Isotopeneffekt bei den massenabhängigen Eigenschaften. So hat das schwere Wasser einen messbar höheren Siedepunkt als Wasser.
Das radioaktive Isotop Tritium wird in Kernreaktoren in industriell verwertbaren Mengen hergestellt. Außerdem ist es neben Deuterium ein Ausgangsstoff bei der Kernfusion zu Helium. In der zivilen Nutzung dient es in Biologie und Medizin als radioaktiver Marker. So lassen sich beispielsweise Tumorzellen aufspüren. In der Physik ist es einerseits selbst Forschungsgegenstand, andererseits untersucht man mit hochbeschleunigten Tritiumkernen schwere Kerne oder stellt künstliche Isotope her.
Mit Hilfe der Tritiummethode lassen sich Wasserproben sehr genau datieren. Mit einer Halbwertszeit von etwa zwölf Jahren eignet es sich besonders für die Messung relativ kurzer Zeiträume (bis zu einigen hundert Jahren). Unter anderem lässt sich so das Alter eines Weines feststellen.
Es findet auch Verwendung als langlebige, zuverlässige Energiequelle für Leuchtfarben (im Gemisch mit einem Fluoreszenzfarbstoff), vor allem in militärischen Anwendungen, aber auch in Armbanduhren. Weitere militärische Verwendung findet das Isotop in der Wasserstoffbombe und gewissen Ausführungen von Kernwaffen, deren Wirkung auf Spaltung beruht.
Wasserstoff als Energiespeicher
Wasserstoff gilt als Energieträger der Zukunft.[19] (→ Siehe auch Hauptartikel: Wasserstoffwirtschaft)
Wasserstoff als Energieträger verursacht keine schädlichen Emissionen, insbesondere kein Kohlendioxid, wenn er aus erneuerbaren Energien wie Wind, Sonne oder Biomasse gewonnen wird.
Wasserstoffgas enthält mehr Energie pro Gewichtseinheit als jeder andere chemische Brennstoff. Wasserstoff ist, wie auch elektrische Energie, keine Primärenergie sondern muss, analog zur Stromerzeugung, aus Primärenergie hergestellt werden. (→ Siehe auch Hauptartikel: Wasserstoffherstellung)
Die technischen Probleme bei der Speicherung von Wasserstoff gelten heute als gelöst. Verfahren wie Druck- und Flüssigwasserstoffspeicherung und die Speicherung in Metallhydriden befinden sich im kommerziellen Einsatz. Daneben existieren weitere Verfahren, die sich noch im Stadium der Entwicklung oder in der Grundlagenforschung befinden. (→ Siehe auch Hauptartikel: Wasserstoffspeicherung)
Die verschiedenen Speichermethoden werden nach ihren Eigenschaften und den spezifischen Anforderungen der Fahrzeuge (z. B. PKW, Bus, Schiff, Flugzeug) eingesetzt:
- die Speicherung von gasförmigem Wasserstoff in Druckbehältern,
- die Speicherung von flüssigem Wasserstoff in vakuumisolierten Behältern,
- die Einlagerung von Wasserstoff in Metallhydriden oder in Kohlenstoff-Nanoröhren.
Die ersten beiden Methoden erlauben eine einfache Wiedergewinnung des Wasserstoffs. Drucktanks aus kohlenstofffaserverstärktem Kunststoff mit bis zu 800 bar sind Behälter die allen Sicherheitsanforderungen der Fahrzeughersteller entsprechen[20] und vom TÜV abgenommen sind.[21]
Da sich das Sicherheitsventil für Überdruck innerhalb des Tanks befindet, wird Wasserstoff im Notfall schrittweise abgegeben und verflüchtigt sich schnell. Wenn eine Zündquelle in der Nähe ist, kann sich der Wasserstoff entzünden, verbrennt aber schnell und mit geringer Wärmeabstrahlung. Eine Explosion ist nahezu unmöglich, da die Konzentration des Wasserstoffs in der Luft nicht ausreicht. Reiner Wasserstoff ist nicht explosiv.
Dagegen sind die herkömmlichen Plastikbenzintanks deutlich unsicherer. Sollte ein Benzinauto brennen können sich durch die höhere Wärmeabstrahlung brennbare Stoffe, wie z. B. Autositze, schneller entzünden.
Speicherung in Hydriden oder Nanoröhren stellen die sichersten Methoden dar. Die Tanks sind allerdings schwerer, in einem 200-kg-Tank können nur etwa 2 kg Wasserstoff gespeichert werden, was energetisch etwa 8 Litern Benzin entspricht. Auch ist die Rückgewinnung gasförmigen Wasserstoffs durch Wärmezuführung aufwändiger. Diese Form der Speicherung ist kostenintensiver als die Speicherung in Druck- und Flüssiggastanks.
Energiedichten im Vergleich
Auf die Masse bezogen:[22]
- Wasserstoff: 33,3 kWh/kg
- Erdgas: 13,9 kWh/kg
- Benzin: 12,7 kWh/kg
Auf das Volumen bezogen:
- Wasserstoff (flüssig): 2360 kWh/m³
- Benzin: 8760 kWh/m³
- Erdgas (20 MPa): 2580 kWh/m³
- Wasserstoffgas (20 MPa): 530 kWh/m³
- Wasserstoffgas (Normaldruck): 3 kWh/m³
Kernfusion
Schon bald nach den Anfängen der Kernphysik im ersten Viertel des 20. Jahrhunderts wurde die Aufmerksamkeit der Physiker auf die Energiegewinnung gelenkt. Neben der Kernspaltung wurde auch der Weg einer Verschmelzung der Kerne, die Kernfusion, erforscht. Die ersten gefundenen Reaktionen sind die Proton-Proton-Reaktionen, bei denen Wasserstoffkerne direkt zu Helium verschmelzen. Das konnte die Energiegewinnung in leichten Sternen, wie unserer Sonne, größtenteils erklären. Zwischen 1937 und 1939 entwickelten Hans Bethe und Carl Friedrich von Weizsäcker eine Theorie zur Kernfusion in sehr schweren Sternen, den nach ihnen benannten Bethe-Weizsäcker-Zyklus. Darin spielt Wasserstoff die überwiegende Rolle in der Energiegewinnung. Er wird aber nicht direkt zu Helium verschmolzen, sondern fusioniert in verschiedenen Reaktionen mit Kohlenstoff, Stickstoff und Sauerstoff. Am Ende des Zyklus entsteht Helium; die anderen Elemente wirken als Katalysatoren.
Während des Kalten Krieges bauten die Großmächte ihre nuklearen Waffenarsenale aus. Der Schritt zu den Fusionswaffen gelang zuerst den USA: basierend auf der Atombombe, die ihre Energie aus der Kernspaltung bezieht, konstruierten amerikanische Forscher unter Edward Teller die Wasserstoffbombe. In ihr wird durch die Kernfusion ein Vielfaches der Energie einer Uranbombe freigesetzt. 1952 testen die Vereinigten Staaten die erste Wasserstoffbombe auf einer kleinen Pazifikinsel. Brennstoff war allerdings nicht Wasserstoff, sondern das Isotop Deuterium. Es war die erste vom Menschen erzeugte Kernfusion. In der Bombe liefen vor allem folgende Kernreaktionen ab:
Das entstandene Tritium und Helium-3 können noch weiter reagieren:
In Summe entstehen aus drei Deuteronen ein Heliumkern sowie ein Neutron und ein Proton.
Da Deuterium wie Wasserstoff schwer zu speichern ist, wird bei den meisten Fusionswaffen inzwischen auf Lithium-Deuterid LiD als Brennstoff zurückgegriffen. Durch die bei der Primärreaktion von Deuterium entstehenden Neutronen wird aus dem Lithium Tritium erbrütet:


- Der Neutronenbeschuss von Lithium erzeugt Helium und den Fusionsbrennstoff Tritium.
Bei der Reaktion mit Lithium-6 wird zudem noch Energie frei, während die Reaktion mit Lithium-7 Energie verbraucht, dafür aber wieder ein Neutron erzeugt, das für die weitere Tritium-Produktion zur Verfügung steht.
Physiker forschen aber auch an einer friedlichen Nutzung der Kernverschmelzung. Früh entwickelten sie verschiedene Vorschläge zur Energiegewinnung durch Fusion. Die gewaltigen Temperaturen, die zu einer Kernfusion nötig sind, bereiten bei einer kontrollierten Reaktion aber nach wie vor Schwierigkeiten. Vor einigen Jahrzehnten wurden die ersten Forschungsreaktoren errichtet, die Wasserstoff zu Helium verschmelzen sollen. Mittlerweile existieren einige dieser Vorrichtungen; beispielsweise JET und ITER (international, in Planung) in Europa, ein deutscher Tokamak-Reaktor in Garching sowie der Stellarator Wendelstein 7-X, welcher derzeit am Max-Planck-Institut für Plasmaphysik (IPP) in Greifswald aufgebaut wird.
Falls diese Experimente an den Forschungsanlagen erfolgreich verlaufen, sollen die gewonnenen Erkenntnisse für den Bau eines Demonstrationskraftwerks (DEMO) dienen. Die gegenwärtigen Planungen gehen von der Inbetriebnahme von DEMO etwa 2030 und der möglichen kommerziellen Nutzung ab etwa 2050 aus. Diese kommerziellen Reaktoren werden aber anders als Wasserstoffbomben voraussichtlich nur die Deuterium-Tritium-Reaktion zur Energiegewinnung nutzen können, und sind somit unbedingt auf Lithium zur Erbrütung des eigentlichen Brennstoffs Tritium angewiesen. Während Deuterium über die Weltmeere in fast beliebiger Menge zur Verfügung steht, sind die bekannten Lithium-Vorräte beschränkt.
Kernfusion in Sonne und Sternen
Mit Wasserstoffbrennen wird die Kernfusion von Wasserstoff in Helium im Inneren von Sternen (oder im Fall einer Nova, auf der Oberfläche eines Weißen Zwergs) bezeichnet. Diese Reaktion stellt in normalen Sternen während des Großteils ihres Lebenszyklus die wesentliche Energiequelle dar. Sie hat trotz ihres historisch bedingten Namens nichts mit einer chemischen Verbrennung zu tun.
Der Prozess der Kernfusion kann beim Wasserstoffbrennen auf zwei Arten ablaufen, bei denen auf verschiedenen Wegen jeweils vier Protonen, die Atomkerne des Wasserstoffs, in einen Heliumkern 4He umgewandelt werden:
- die relativ direkte Proton-Proton-Reaktion
- der schwere Elemente (Kohlenstoff, Stickstoff, Sauerstoff) nutzende Bethe-Weizsäcker-Zyklus (CNO-Zyklus)
Für die exakte Berechnung der freigesetzten Energie ist zu berücksichtigen, dass in Teilreaktion der Proton-Proton-Reaktion und auch des Bethe-Weizsäcker-Zyklus zwei Positronen freigesetzt werden, die bei der Annihilation mit einem Elektron 1,022 MeV entsprechend den Ruhemassen von Elektron und Positron freisetzen. Zur Massendifferenz der vier Protonen und des Heliumkerns ist folglich die zweifache Elektronenmasse zu addieren. Diese Massendifferenz ist identisch der Differenz der vierfachen Atommasse von Protium, Wasserstoff bestehend aus Protonen und Elektronen und der Atommasse von 4He. Diese Atommassen sind näherungsweise aber nicht exakt identisch mit den Atommassen von Wasserstoff und Helium, da es verschiedene Isotope dieser Elemente gibt. Ferner verlässt ein kleiner Teil der Energie die Sonne in Form von Neutrinos.
Insgesamt wird beim Wasserstoffbrennen etwa 0,73 % der Masse in Energie umgewandelt, was man als Massendefekt bezeichnet. Die aus der Massendifferenz erzeugte Energie ergibt sich aus der einsteinschen Beziehung E = mc². Sie resultiert aus der Kernbindungsenergie der Nukleonen, der Kernbausteine.
Die Fusion von Wasserstoff zu Helium ist am ergiebigsten; die nächste Stufe stellarer Fusionsreaktionen, das Heliumbrennen, setzt pro erzeugtem Kohlenstoffkern nur noch etwa ein Zehntel dieser Energie frei.
Biologische Bedeutung
Wasserstoff ist in Form verschiedenster Verbindungen essentiell für alle bekannten Lebewesen. An vorderster Stelle zu nennen ist hier Wasser, welches als Medium für alle zellulären Prozesse und für alle Stofftransporte dient. Zusammen mit Kohlenstoff, Sauerstoff, Stickstoff (und seltener auch anderen Elementen) ist er Bestandteil derjenigen Moleküle aus der organischen Chemie, ohne die jegliche uns bekannte Form von Leben schlicht unmöglich ist.
Wasserstoff spielt im Organismus auch aktive Rollen, so bei einigen Koenzymen wie z. B. Nicotinamid-Adenin-Dinucleotid (NAD/NADH), die als Reduktionsäquivalente (oder „Protonentransporter“) im Körper dienen und bei Redoxreaktionen mitwirken. In den Mitochondrien, den Kraftwerken der Zelle, dient die Übertragung von Wasserstoffkationen (Protonen) zwischen verschiedenen Molekülen der so genannten Atmungskette dazu, ein Potential, einen Protonengradienten, zur Generierung von energiereichen Verbindungen wie Adenosintriphosphat (ATP) bereitzustellen. Bei der Photosynthese in Pflanzen und Bakterien wird der Wasserstoff aus dem Wasser dazu benötigt, das fixierte Kohlendioxid in Kohlenhydrate umzuwandeln.
Bezogen auf die Masse ist Wasserstoff im menschlichen Körper das drittwichtigste Element: Bei einer Person mit einem Körpergewicht von 70 kg, sind rund 7 kg (= 10 Gew.-%) auf den enthaltenen Wasserstoff zurückzuführen. Nur Kohlenstoff (ca. 20 Gew.-%) und Sauerstoff (ca. 63 Gew.-%) machen einen noch größeren Gewichtsanteil aus. Bezogen auf die Anzahl der Atome ist der sehr leichte Wasserstoff sogar das mit Abstand häufigste Atom im Körper eines jeden Lebewesens. (Die 7 kg beim Menschen entsprechen 3,5·103 Mol Wasserstoff mit je 2·6·1023 Atomen, das sind rund 4,2·1027 Wasserstoffatome).
Medizinische Bedeutung
In biologischen Systemen reagiert molekularer Wasserstoff mit reaktiven Sauerstoffspezies und wirkt so als Antioxidans. Im Tierversuch führt die Anreicherung von Trinkwasser mit molekularem Wasserstoff nach Nierentransplantation zu einem besseren Überleben des Transplantates, zu einem verminderten Auftreten einer chronischen Schädigung des Transplantates, zu einer Verminderung der Konzentration an reaktiven Sauerstoffspezies und zu einer Hemmung von Signalwegen, welche die entzündliche Aktivität verstärken (proinflammatorische Signalwege).[23]
Sicherheitshinweise
Wasserstoff ist hochentzündlich; es reagiert mit reinem Sauerstoff oder Luft sowie mit anderen gasförmigen Oxidationsmitteln wie Chlor oder Fluor mit heißer Flamme. Gemische mit Chlor oder Fluor sind schon durch UV-Licht entzündlich (siehe Chlorknallgas). Außer der nach GHS vorgeschriebenen Kennzeichnung (siehe Info-Box) müssen H2-Druckgasflaschen nach DIN EN 1089-3 mit roter Flaschenschulter und rotem Flaschenkörper versehen sein.
Wasserstoff ist ungiftig und schädigt auch nicht die Umwelt. Daher ist auch kein MAK-Wert festgelegt. Atem- oder Hautschutz sind nicht erforderlich. Erst wenn hohe Konzentrationen eingeatmet werden, können durch den Mangel an Sauerstoff ab etwa 30 Vol% Bewegungsstörungen, Bewusstlosigkeit und Ersticken auftreten.[24]
Beim Mischen mit Luft zu 4 bis 76 Volumenprozent (Vol.-%) ist Wasserstoff entzündlich. Erst bei einer Konzentration von 18 % in der Luft ist Wasserstoff explosiv (Knallgas). Die Zündtemperatur in Luft beträgt 560 °C.[25] Das Sicherheitsdatenblatt ist zu beachten.[26] Bei der Handhabung ist der Wasserstoff von Zündquellen, einschließlich elektrostatischen Entladungen, fernzuhalten. Die Lagerung der Behälter sollte fern von oxidierenden Gasen (Sauerstoff, Chlor) und anderen brandfördernden Stoffen erfolgen.
Sauerstoff/Wasserstoffgemische mit einem Anteil von unter 10,5 Volumenprozent Wasserstoff sind schwerer als Luft und sinken zu Boden.[27] Die Entmischung erfolgt nicht unmittelbar, so das bis zur Unterschreitung der 4-Volumenprozent-Grenze die Zündfähigkeit erhalten bleibt. Beim Umgang mit Wasserstoff müssen Sicherheitsvorschriften und Entlüftungsanlagen dieses Verhalten berücksichtigen.
Wird Wasserstoff in einfachen Metalltanks unter Druck gelagert, so kommt es wegen der geringen Molekülgröße zur Diffusion, das heißt, Gasmoleküle treten langsam durch die Gefäßwände aus. Die heute für Gastanks und Leitungen verwendeten Materialien berücksichtigen diese Eigenschaften des Wasserstoffs,[28][29] so dass im täglichen Gebrauch keine größeren Risiken entstehen als z. B. durch die Verwendung von Benzin.[30][31][32] Wasserstofffahrzeuge mit Drucktanks können problemlos in Parkhäusern und Tiefgaragen geparkt werden. Es existiert keine gesetzliche Bestimmung, die das einschränkt (siehe dazu: Wasserstoffspeicherung).
Der Austausch von Wasserstoff-Isotopen in chemischen Verbindungen kann die Toxizität der entsprechenden Verbindung beeinflussen. So ist Schweres Wasser (D2O) – das Isotop 1H wurde gegen 2H (Deuterium) ausgetauscht – im Vergleich zu Wasser giftig für viele Lebewesen. Die für Menschen gefährliche Menge ist aber recht groß und im Regelfall kaum zu erreichen.
Nachweis
Molekularen Wasserstoff kann man durch die Knallgasprobe nachweisen. Bei dieser Nachweisreaktion wird eine kleine, beispielsweise während einer Reaktion aufgefangene Menge eines Gases, in einem Reagenzglas entzündet. Wenn danach ein dumpfer Knall, ein Pfeifen oder ein Bellen zu hören ist, so ist der Nachweis positiv (das heißt, es war Wasserstoff in dem Reagenzglas). Der Knall kommt durch die Reaktion von Wasserstoffgas mit dem Luftsauerstoff zustande:
 (exotherme Reaktion)
(exotherme Reaktion)- Wasserstoff reagiert mit Sauerstoff zu Wasser
Mit der gleichen Reaktion verbrennt Wasserstoff mit einer schwach bläulichen Flamme, wenn man ihn gleich an der Austrittsstelle entzündet (Pfeifgas).
Die Knallgasprobe ist die „klassische“ Methode zum Nachweis und ist besonders in Schulversuchen beliebt. Sehr viel genauer lässt sich das Element mit Hilfe der Kernspinresonanzspektroskopie (kurz NMR; nuclear magnetic resonance) nachweisen, die daher bevorzugt im Laborbetrieb angewandt wird. Dabei macht man sich quantenmechanische Gegebenheiten zu Nutze: Der Kernspin eines Wasserstoffatoms kann sich in einem angelegten äußeren Magnetfeld unterschiedlich ausrichten. Dadurch liegt der Atomkern in einem von zwei möglichen Energiezuständen vor, deren Differenz umso größer ist, je stärker das äußere Magnetfeld ist. Diese Differenz ist charakteristisch für jedes Element und kann durch Strahlungsanregung gemessen werden.
Verbindungen
Wasserstoff geht mit den meisten chemischen Elementen Verbindungen mit der allgemeinen Summenformel EHn (n = 1, 2, 3, 4) ein. Einige wenige dieser Elementwasserstoffe sind nur in Form so genannter Addukte bekannt, wie Lm • EHn (L steht für einen Liganden).
Wasserstoff kann in Verbindungen sowohl positive als auch negative Ladungsanteile tragen. Das ist abhängig davon, ob der Bindungspartner eine höhere oder eine niedrigere Elektronegativität als Wasserstoff (2,2) besitzt. Zwischen den beiden Verbindungstypen lässt sich im Periodensystem keine scharfe Grenze ziehen, da zum Beispiel das Säure-Base-Verhalten mit berücksichtigt werden muss. Eine mehr oder weniger willkürliche Betrachtung besagt, dass in den Wasserstoffverbindungen der Elemente Bor, Silicium, Germanium, Zinn und Blei sowie allen links davon der Wasserstoff negativ polarisiert ist, in Verbindungen mit Kohlenstoff, Phosphor, Arsen, Antimon, Bismut und allen Elementen rechts davon positiv. Entsprechend lässt sich bei Monosilan (SiH4) die Oxidationszahl für Silicium auf +4 (Wasserstoff dementsprechend −1), in Methan (CH4) für Kohlenstoff auf −4 (Wasserstoff +1) festlegen.
Zur Darstellung von Wasserstoffverbindungen EHn werden hauptsächlich drei verschiedene Verfahren genutzt:
- Die Umsetzung des entsprechenden Elements E mit Wasserstoff (H2; Hydrogenolyse)

- Ein Element reagiert mit Wasserstoff bei Energiezufuhr zum entsprechenden Elementwasserstoff.
- Die Reaktion von Metallverbindungen des Typs MnE mit Wasserstoffsäuren (H+; Protolyse)

- Eine Metallverbindung des Elements E reagiert mit einer Säure HA zum Elementwasserstoff und einem Metallsalz.
- Die Umsetzung von Halogenverbindungen (EHaln) mit Hydriden (H−; Hydridolyse)

- Hydridionen setzen aus einer Halogenverbindung des Elements E den entsprechenden Elementwasserstoff frei.
Salzartige Verbindungen
In Verbindung mit Metallen kann Wasserstoff jeweils ein Elektron aufnehmen, so dass negativ geladene Wasserstoffionen (Hydridionen, H−) entstehen, die mit Metallkationen Salze bilden. Diese Verbindungen werden Hydride genannt. Salzartige Elementwasserstoffe sind von den Alkali- und, mit Ausnahme von Beryllium, den Erdalkalimetallen bekannt. Außerdem zählt man die Dihydride des Europiums und Ytterbiums (EuH2 und YbH2) dazu.
Metallhydride reagieren sehr heftig mit Wasser unter Freisetzung von molekularem Wasserstoff (H2) und können sich an der Luft selbst entzünden, wobei sich Wasser und das Metalloxid bilden. In der Mehrzahl sind sie aber nicht explosiv. Minerale, die (an Sauerstoff gebundenen) Wasserstoff enthalten, sind Hydrate oder Hydroxide.
Metallartige Verbindungen
In metallartigen Wasserstoffverbindungen – mit wenigen Ausnahmen sind das die Übergangsmetallhydride – ist atomarer Wasserstoff in der entsprechenden Metallstruktur eingelagert. Man spricht in diesem Fall auch von Wasserstoff-Einlagerungsverbindungen, obwohl sich bei der Aufnahme des Wasserstoffs die Struktur des Metalls ändert (was eigentlich nicht der Definition für Einlagerungsverbindungen entspricht). Das Element besetzt die oktaedrischen und tetraedrischen Lücken in den kubisch- bzw. hexagonal-dichtesten Metallatompackungen.
Die Löslichkeit von Wasserstoff steigt mit zunehmender Temperatur. Man findet jedoch selbst bei Temperaturen über 500 °C selten mehr als 10 Atomprozente Wasserstoff im betreffenden Metall. Am meisten Wasserstoff können die Elemente Vanadium, Niob und Tantal aufnehmen. Bei Raumtemperatur sind folgende Stöchiometrien zu beobachten: VH0,05, NbH0,11 und TaH0,22. Ab 200 °C findet man bei diesen Metallen eine 1:1-Stöchiometrie (MH) vor. Das kubisch-raumzentrierte Kristallgitter bleibt dabei unangetastet.
Kovalente Verbindungen
Verbindungen, bei denen Wasserstoff der elektropositivere Partner ist, haben einen hohen kovalenten Anteil. Als Beispiele seien Fluorwasserstoff (HF) oder Chlorwasserstoff (HCl) genannt. In Wasser reagieren diese Stoffe als Säuren, da der Wasserstoff sofort als Proton (H+-Ion) von umgebenden Wassermolekülen abgespalten werden kann. Isolierte H+-Ionen verbinden sich in wässriger Lösung sofort mit Wassermolekülen zu H3O+-Ionen; dieses Ion ist verantwortlich für die saure Eigenschaft von wässrigen Chlorwasserstofflösungen.
Säure-Base-Verhalten
Schematische Darstellung verschiedener Wasserstoffoxide
Die kovalenten Wasserstoffverbindungen der Elemente der IV. bis VII. Hauptgruppe des Periodensystems sowie Borwasserstoffe sind Säuren nach der Definition von Brønsted, geben also Protonen an andere Verbindungen ab.
Die Säurestärke der Verbindungen nimmt dabei in den Hauptgruppen von oben nach unten und in den Perioden von links nach rechts zu. Ebenso steigt sie mit der Zahl der Element-Element-Bindungen bei Wasserstoffverbindungen eines bestimmten Elements. So ist zum Beispiel Wasser (H2O) eine schwächere Säure als Wasserstoffperoxid (H2O2), Ethan (C2H6) in der Säurestärke schwächer als Ethen (C2H4) und Ethin (C2H2).
Umgekehrt können kovalente Elementwasserstoffe als Basen fungieren. Wasserstoffverbindungen der Elemente aus Hauptgruppe V bis VII können Protonen aufnehmen, da sie über freie Elektronenpaare verfügen.
pH-Wert
Ursache für die Acidität oder Basizität einer wässrigen Lösung ist die Stoffkonzentration an Protonen (H+-Ionen). Den negativen dekadischen Logarithmus dieser Konzentration nennt man pH-Wert. Z. B. bedeutet eine Konzentration von 0,001 mol H+-Ionen pro Liter Wasser „pH 3,0“. Dieses Beispiel trifft auf eine Säure zu. Wasser ohne jeden Zusatz hat bei Normalbedingungen den pH 7, Basen haben pH-Werte bis 14
Oxide
Wasserstoffoxide (auch Hydrogeniumoxide) sind Verbindungen, die nur aus Wasserstoff und Sauerstoff bestehen, von größter Wichtigkeit ist das Wasser (Wasserstoffoxid); von technischer Bedeutung ist daneben Wasserstoffperoxid, früher Wasserstoffsuperoxid genannt. Ein weiteres, aber selteneres Oxid ist das Dihydrogentrioxid.
Von außerordentlicher Bedeutung für alles Leben auf der Erde sind auch Alkohole und Saccharide sowie Carbonsäuren, die (nur) Wasserstoff, Sauerstoff und Kohlenstoff enthalten.
Kohlenwasserstoffe
Wasserstoff bildet mit Kohlenstoff die kovalenten Kohlenwasserstoffe, deren Studium sich die Kohlenwasserstoffchemie verschrieben hat.
Siehe auch
- Wasserstoffwirtschaft
- Wasserstoffherstellung
- Wasserstoffspeicher
- Wasserstoffantrieb
- Liste der Wasserstofftechnologien
Literatur
Chemie
- Erwin Riedel: Anorganische Chemie. de Gruyter, Berlin 2002, ISBN 3-11-017439-1.
- A. F. Holleman, Egon Wiberg: Lehrbuch der Anorganischen Chemie. de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
Technik
- Sven Geitmann: Wasserstoff & Brennstoffzellen – Die Technik von morgen. 2. Aufl. Hydrogeit Verlag, Kremmen 2004, ISBN 3-937863-04-4.
- Alf-Sibrand Rühle: Wasserstoff & Wirtschaft – Investieren in eine saubere Zukunft Hydrogeit Verlag, Kremmen 2005, ISBN 3-937863-02-8.
- Rex A. Ewing: Hydrogen – A Journey Into a World of Hydrogen Energy and Fuel Cells. Pixyjack Press, Masonville CO 2004, ISBN 0-9658098-6-2.
Bedeutung
- Hoimar von Ditfurth: Im Anfang war der Wasserstoff. dtv, München 2002, ISBN 3-423-33015-5.
Weblinks
 Wiktionary: Wasserstoff – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Wasserstoff – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen Commons: Wasserstoff – Album mit Bildern und/oder Videos und Audiodateien
Commons: Wasserstoff – Album mit Bildern und/oder Videos und Audiodateien Wikibooks: Wikijunior Die Elemente/ Elemente/ Wasserstoff – Lern- und Lehrmaterialien
Wikibooks: Wikijunior Die Elemente/ Elemente/ Wasserstoff – Lern- und Lehrmaterialien- Links zum Thema Wasserstoff im Open Directory Project
- 3D Visualisierungen des Wasserstoffatoms bei HydrogenLab
- Informationen über Wasserstoff bei hydrox.de
- Suprafluider Wasserstoff bei Innovationsreport 4. Juni 2002
- Informationen und Bücher über Wasserstoff im Verlag Hydrogeit
- Wasserstoff – Der neue Energieträger Über die Rolle des Wasserstoffs in existierenden und zukünftigen Energiesystemen in Deutscher Wasserstoff- und Brennstoffzellenverband e.V. (Hrsg.) 2004 (PDF-Datei; 150 KB)
- Solare Wasserstoffwirtschaft bei biowasserstoff.de
- Wasserstofftestfeld Island in Iceland Guide 2006
- Eine Wasserstoff- und Deuterium-Spektralröhre Betrieb mit 1,8 kV, 18 mA und einer Frequenz von 35 kHz.
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Wasserstoff) entnommen.
- ↑ Angegeben ist der von der IUPAC empfohlene Standardwert, da die Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für das mittlere Atomgewicht der in Klammern angegebene Massenbereich. Siehe: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure and Applied Chemistry. 2010, S. 1, doi:10.1351/PAC-REP-10-09-14.
- ↑ a b Eintrag zu Wasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Juli 2009 (JavaScript erforderlich).
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC (Chemical Rubber Publishing Company), Boca Raton 2009, ISBN 978-1-4200-9084-0, S. 6-113.
- ↑ a b Eintrag zu CAS-Nr. 1333-74-0 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Ernst F. Schwenk: Sternstunden der frühen Chemie. Verlag C.H. Beck, 1998, ISBN 3-406-45601-4.
- ↑ Webmineral – Mineral Species sorted by the element H (Hydrogen) (englisch).
- ↑ IDW-Online 28. September 2011
- ↑ RÖMPP, 9. erweiterte Auflage.
- ↑ a b c d P.J. Linstrom and W.G. Mallard, Eds., NIST Chemistry WebBook, NIST Standard Reference Database Number 69, June 2005, National Institute of Standards and Technology, Gaithersburg MD, 20899.
- ↑ Römpps Chemielexikon achte Auflage 1988.
- ↑ George A. Jeffrey: An Introduction to Hydrogen Bonding. Oxford University Press, 1997, ISBN 978-0-19-509549-4.
- ↑ physicsweb.org: Hydrogen-7 makes its debut
- ↑ D. Lal und B. Peters: Cosmic ray produced radioactivity on the earth. Handbuch der Physik, Band 46/2, Springer, Berlin 1967, S. 551–612.
- ↑ a b c Chemie mit ungewöhnlichen Elementarteilchen, spektrumdirekt 28. Januar 2011.
- ↑ ZZulV: Verordnung über die Zulassung von Zusatzstoffen zu Lebensmitteln zu technologischen Zwecken
- ↑ Wasserstoff als Energieträger der Zukunft (Quelle: VDE Abgerufen am 3. August 2011)
- ↑ Anforderungen an Kunststoffe für Wasserstoff-Hochdrucktanks (Quelle: Adam Opel GmbH, Stand: 30. Juni 2002)
- ↑ Hochleistungs-Wasserstofftank erhält TÜV-Zertifikat (Quelle: Motor-Talk, Stand: Stand: 30. Juni 2002)
- ↑ Energieinhalte im Vergleich
- ↑ Jon S Cardinal, Jianghua Zhan, Yinna Wang, Ryujiro Sugimoto, Allan Tsung, Kenneth R McCurry, Timothy R Billiar, Atsunori Nakao: Oral hydrogen water prevents chronic allograft nephropathy in rats. In: Kidney International. 77, Nr. 2, 2010-01, S. 101–109. doi:10.1038/ki.2009.421. Abgerufen am 21. April 2010.
- ↑ Helmut Eichlseder, Manfred Klell: Wasserstoff in der Fahrzeugtechnik, 2010, ISBN 978-3-8348-0478-5.
- ↑ Wasserstoff so sicher wie Benzin Quelle: Linde AG
- ↑ EG Sicherheitdatenblatt Wasserstoff verdichtet Quelle: Linde AG Stand: 15. November 2010.
- ↑ ZDF abenteuer wissen
- ↑ Anforderungen an Kunststoffe für Wasserstoff-Hochdrucktanks Quelle: Adam Opel GmbH Stand: 30. Juni 2002.
- ↑ Hochleistungs-Wasserstofftank erhält TÜV-Zertifikat Quelle: Motor-Talk Stand: 30. Juni 2002.
- ↑ Spektakulärer Test zeigt: Wasserstoff im Auto muss nicht gefährlicher sein als Benzin Quelle: Bild der Wissenschaft Stand: 3. Februar 2003.
- ↑ Sicherheitsaspekte bei der Verwendung von Wasserstoff Quelle: Hycar
- ↑ Video: Chrashversuch der University of Miami
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase 
Dieser Artikel wurde am 7. Dezember 2005 in dieser Version in die Liste der exzellenten Artikel aufgenommen. Kategorien:- Feuergefährlicher Stoff
- Gruppe-1-Element
- Nichtmetall
- Periode-1-Element
- Chemisches Element
- Wikipedia:Exzellent
- Kraftstoff
- Brenngas
- Wasserstofftechnik
- Kühlmittel
- Lebensmittelzusatzstoff
Wikimedia Foundation.















