- tert-Butyllithium
-
Strukturformel 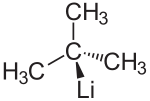
Allgemeines Name tert-Butyllithium Andere Namen - t-Butyllithium
- t-BuLi
Summenformel C4H9Li CAS-Nummer 594-19-4 Kurzbeschreibung farbloser, pyrophorer Feststoff[1]
Eigenschaften Molare Masse 64,05 g·mol−1 Aggregatzustand fest
Schmelzpunkt 140 °C (Zersetzung)[2]
Löslichkeit Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. tert-Butyllithium (t-BuLi) ist eine tertiäre metallorganische Verbindung des Elements Lithium (Organolithium-Verbindung). Daneben gibt es noch die isomeren Formen n-Butyllithium und sec-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. t-BuLi ist somit die stärkste Base in dieser Reihe. t-BuLi zerfällt bei Raumtemperatur in Lithiumhydrid und Isobuten. Das entstandene Isobuten wird durch weiteres t-BuLi in der Allylstellung deprotoniert, was zu einer weiteren Konzentrationserniedrigung des t-BuLi führt.
Inhaltsverzeichnis
Darstellung
Die Synthese kann durch Reaktion von Lithium (Pulver) erfolgen.
Eigenschaften
Im Handel ist es ausschließlich als Lösung in Alkanen (zumeist in Pentan oder Heptan) erhältlich, wobei eine Konzentration von 1,7 mol/L üblich ist. Ether wie THF oder Diethylether sind als Lösemittel zur Lagerung ungeeignet, da sie rasch zersetzt werden. t-BuLi ist auch in Lösung äußerst pyrophor und verbrennt an der Luft mit einer typisch roten Flamme.
Reaktionen
Die Lithium-Kohlenstoff-Bindung im tert-Butyllithiummolekül ist stark polarisiert. Das Kohlenstoffatom trägt dabei eine negative und das Lithiumatom eine positive Partialladung. tert-Butyllithium verhält sich daher chemisch ähnlich wie ein entsprechendes Carbanion. Durch Formulierung einer mesomeren Grenzstruktur lässt sich dieses Verhalten veranschaulichen:[4]
Ähnlich wie n-Butyllithium kann auch t-BuLi für den Lithium-Halogenaustausch und zum Deprotonieren von Aminen und aktivierten C-H-Verbindungen verwendet werden. t-BuLi kann zudem die Alpha-Position der Ether angreifen.Dies zeigt das Beispiel Tetrahydrofuran, welches bereits bei Raumtemperatur innerhalb von Minuten zersetzt wird:
Diese Methode wird zum Beispiel benutzt, wenn deprotonierter Acetaldehyd benötigt wird.
Verwendung
t-BuLi hat in der modernen synthetischen organischen Chemie Bedeutung als ultrastarke Base bzw. als Lithiierungsreagenz erlangt. Da es einiges pyrophorer als n-BuLi ist, wird es weniger oft eingesetzt. In einigen Fällen wird es wegen der höheren Basizität oder aus sterischen Gründen (der t-Butylrest ist räumlich relativ groß) verwendet.
Sicherheitshinweise
Wie oben erwähnt ist t-BuLi auch in Lösung äußerst pyrophor. Die Handhabung und Lagerung muß daher stets unter Schutzgas stattfinden. t-BuLi reagiert zudem heftig mit Wasser zu Lithiumhydroxid und Isobutan. Bei längerer Lagerung bildet sich ein Bodensatz aus ebenfalls pyrophorem Lithiumhydrid (aus der Selbstzersetzung) und Lithiumhydroxid (eingedrungene Feuchtigkeit).
Quellen
- ↑ Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Ulrich Wietelmann, Richard Bauer: Lithium and Lithium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a15 393.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 3. Auflage. Wiley-VCH, 2005, ISBN 978-3-527-29819-8
Kategorien:- Lithiumverbindung
- Metallorganische Verbindung
Wikimedia Foundation.




