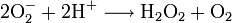- Superoxid-Dismutase
-
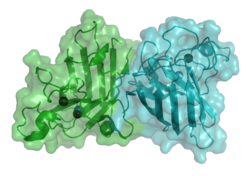
Superoxiddismutase Modell des Dimer der menschlichen zytoplasmatischen SOD nach PDB 2C9U Bezeichner Externe IDs CAS-Nummer: 9054-89-1 Enzymklassifikation EC, Kategorie 1.15.1.1 Oxidoreduktase Reaktionsart Protonierung Substrat 2 O2•- + 2 H+ Produkte O2 + H2O2 Superoxid-Dismutase (SOD) ist der Name für alle Enzyme, die Superoxid-Anionen zu Wasserstoffperoxid umwandeln. Diese Enzyme kommen in allen Lebewesen vor. Superoxid (eine reaktive Sauerstoffspezies) ist sehr reaktionsfreudig und kann Proteine und das Genom schädigen (oxidativer Stress). Die katalysierte Reaktion ist daher besonders wichtig für aerobe Lebewesen.
Defekte an einem SOD-Gen beim Menschen können zu erblichen Krankheiten wie Amyotrophe Lateralsklerose (ALS1) führen. Diese Wirkung hat jedoch nichts mit der Enzym-Eigenschaft der SOD zu tun, sondern mit zytotoxischen Wirkungen von unstabilisierter SOD.[1][2][3]
Inhaltsverzeichnis
Systematik
Es gibt drei leicht unterscheidbare Gruppen von Superoxiddismutasen.[4][5][6][7]
- Kupfer-/Zink-enthaltende SOD: eine Form im Zytoplasma aller Eukaryoten; eine weitere Form in pflanzlichen Chloroplasten; eine extrazelluläre Form in manchen Eukaryoten; und eine periplasmatische Form in Prokaryoten.
- Mangan- oder Eisenhaltige SOD, in allen Lebewesen. Die eisenhaltigen sind in Pflanzen in den Chloroplasten lokalisiert, die manganhaltigen in Mitochondrien und Peroxisomen.
- Superoxiddismutasen aus der Germin-Familie, in der extrazellulären Matrix vieler Pflanzen.
Katalysierte Reaktion
Die oxidierte Form des Enzyms reagiert mit einem Superoxidion unter Bildung von Sauerstoff und der reduzierten Form des Enzyms. Diese Form reagiert weiter mit einem zweiten Superoxidion und zwei Protonen, dabei entsteht Wasserstoffperoxid und die oxidierte Form des Enzyms.
Zwei Moleküle des dabei gebildeten Wasserstoffperoxids reagieren weiter zu einem Molekül Sauerstoff und zwei Molekülen Wasser. Diese Reaktion wird von dem Enzym Katalase katalysiert.
Einzelnachweise
- ↑ UniProt-Eintrag
- ↑ Furukawa Y. et al.: Complete loss of post-translational modifications triggers fibrillar aggregation of SOD1 in familial form of ALS."; J. Biol. Chem. 283/35/2008 S. 24167-24176. PMID 18552350 - doi:10.1074/jbc.M802083200
- ↑ L. Banci et al.: SOD1 and amyotrophic lateral sclerosis: mutations and oligomerization. PLoS ONE 3/-/2008 S. E1677-E1677. PMID 18301754 - doi:10.1371/journal.pone.0001677
- ↑ PROSITE PDOC00082
- ↑ PDOC00083
- ↑ PDOC00597
- ↑ Alscher RG et al.: Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. J Exp Bot 53/372/2002. S. 1331-41. PMID 11997379
Weblinks
- Wirkstoffe unter der Lupe: Superoxiddismutase (SOD): Super-Enzym mit Zellschutzfunktion HautReport-Beitrag aus Heft November/Dezember 2005, Seite 7
Wikimedia Foundation.