- Tetrahydrobiopterin
-
Strukturformel 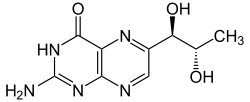
Allgemeines Name Biopterin Andere Namen - 2-Amino-6-(L-erythro- 1,2-dihydroxypropyl)- 3H-pteridin-4-on
- (S-(R*,S*))-2-Amino- 6-(1,2-dihydroxypropyl)- 1H-pteridin-4-on
Summenformel C9H11N5O3 CAS-Nummer 22150-76-1 PubChem 444475 Kurzbeschreibung gelbe Kristalle Eigenschaften Molare Masse 237,22 g·mol−1 Aggregatzustand fest
Schmelzpunkt Zersetzung: ab 250 °C
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Biopterin ist eine heterocyclische Verbindung, die als Redox-Cofaktor im Stoffwechsel bedeutsam ist. Das wesentliche Strukturmerkmal ist ein heterocyclisches Pteridin-Ringsystem, damit ist es ein Derivat des Pterins.
Biologische Bedeutung
Biopterin – genauer das sich daraus ableitende Redoxpaar 7,8-Dihydrobiopterin/(6R)-5,6,7,8-Tetrahydrobiopterin (letzteres auch BH4 abgekürzt) – spielt als Cofaktor eine wichtige Rolle im Stoffwechsels. Im Gegensatz zu den Pteridin-Abkömmlingen Folsäure und Riboflavin kann es jedoch vom menschlichen Körper selbst synthetisiert werden und ist somit nicht essentiell. Nur die Tetrahydroform des Biopterins ist biologisch aktiv.
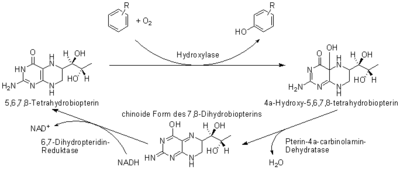
Besondere Bedeutung kommt dem Biopteridin-Redoxsystem bei der Oxidation aromatischer Ringe zu. Eine solche Oxidation findet z. B. bei der Biosynthese der Aminosäure Tyrosin aus Phenylalanin durch die Phenylalaninhydroxylase, bei der Synthese von Catecholaminen im Schritt der Oxidation des Tyrosins zur L-DOPA durch die Tyrosinhydroxylase oder bei der Serotonin-Biosynthese im Schritt der Oxidation des Tryptophans zum 5-Hydroxytryptophan durch die Tryptophanhydroxylase statt. Eine Besonderheit dieser Oxidationen ist, dass sie die Gegenwart molekularen Sauerstoffs erfordern (siehe auch Abbildung zuunterst).
Störungen im Biopterin-Stoffwechsel führen aufgrund der Bedeutung für den Metabolismus aromatischer Aminosäuren u. a. zu sogenannten „atypischen“ Phenylketonurien.
Die Stickstoffmonoxid-Synthase (EC 1.14.13.39, CAS-Nr. 125978-95-2), die über mehrere Stufen Arginin zu NO und Citrullin oxidiert, ist ebenfalls tetrahydrobiopterinabhängig.
Das Redoxsystem Dihydrobiopterin/Tetrahydrobiopterin ist vergleichsweise komplex – man betrachte dazu beispielsweise die Redoxsysteme der Cofaktoren NAD+ oder FAD. Für die Regeneration der oxidierten aus der reduzierten Form sorgt ein eigenes Enzymsystem: die Pterin-4a-carbinolamin-Dehydratase (EC 4.2.1.96) und die Dihydropteridin-Reduktase (EC 1.5.1.34, CAS-Nr. 9074-11-7). Die folgende Abbildung versinnbildlicht den zugehörigen Zyklus:
Die Biosynthese erfolgt analog der Folsäure-Biosynthese aus GTP (siehe auch Abschnitt Weblinks).
Quellen
Weblinks
Wikimedia Foundation.