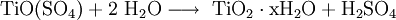- Titanweiß
-
Kristallstruktur 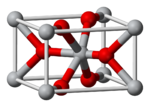
Allgemeines Name Titan(IV)-oxid Andere Namen - Titandioxid
- Titansäureanhydrid
- Rutil
- Anatas
- Brookit
- E 171
- C.I. Pigment White 6
- C.I. 77891
Verhältnisformel TiO2 CAS-Nummer 13463-67-7 Kurzbeschreibung weißes, kristallines Pulver Eigenschaften Molare Masse 79,90 g·mol−1 Aggregatzustand fest
Dichte 4,24 g·cm−3 [1]
Schmelzpunkt Siedepunkt 2900 °C [1]
Löslichkeit schlecht in Flusssäure, konzentrierter Salpeter- und Schwefelsäure, unlöslich in Wasser, Salzsäure, verdünnter Salpeter- und Schwefelsäure
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Thermodynamische Eigenschaften ΔHf0 −249 kJ/mol (Rutil)
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Titan(IV)-oxid (Titandioxid) ist eines der Oxide des Titans.
Inhaltsverzeichnis
Geschichte
Die hervorragende Eignung von Titandioxid als weißes Pigment wurde 1908 in Norwegen und den USA entdeckt. Ab 1916 wurde das Pigment bereits unter der Bezeichnung Kronos Titan White kommerziell hergestellt. In Deutschland begann die Produktion im Jahr 1924 zunächst unter dem Namen Degea-Titanweiß. Bis 1938 wurde das Titanweiß nur in der Anatasform hergestellt, dann aber zunehmend in der Rutilform, die sich als stabiler gegenüber Ölbindemitteln und organischen Farbstoffen erwies. Es wurde daher auch als Rutilweiß bezeichnet.
Im Jahr 2008 betrug die weltweite Produktionsmenge 4,7 Millionen Tonnen, ein Rückgang gegenüber 2007 um 4,9%. Mehr als die Hälfte dieser Menge wird in Beschichtungsstoffen eingesetzt. 70% der Gesamtproduktion werden von fünf Herstellern produziert, wobei neben Kronos und Marktführer DuPont (USA) noch die Unternehmen Cristal (Saudi-Arabien), Tronox (USA) und Huntsman (USA) zu den weltweit größten Produzenten gezählt werden. Die Regionen, die am meisten Titandioxid verbrauchen, sind Nordamerika, Europa und China. Die größten Wachstumsmärkte sind China und Indien.[2][3][4]
Vorkommen
Titan(IV)-oxid kommt in der Natur in drei Modifikationen vor:
- Rutil ist ein tetragonales Mineral von meist prismatischem Habitus. Die Kristallstruktur ordnet in der Raumgruppe 136, das entspricht dem Hermann-Mauguin-Symbol P42/mnm [5]. Das Rutil-TiO2 hat eine Dichte von 4,26 g/cm3. Der Name Rutil stammt vom lateinischen rutilus – rötlich. Es wird besonders gerne als Weißpigment eingesetzt.
- Anatas bildet tetragonale holoedrische Kristalle (holoedrisch bedeutet die höchstsymmetrische Gruppe innerhalb eines Kristallsystems, im tetragonalen damit 4/m 2/m 2/m). Es kristallisiert in der Raumgruppe 141, das heißt I41/amd [5] (nach Hermann-Mauguin). Anatas wandelt sich allmählich (ab einer Temperatur von über 700 °C schneller) irreversibel in Rutil um. Die Dichte von Anatas beträgt 3,88 g/cm3. Anatas dient ebenfalls als Weißpigment.
- Brookit bildet orthorhombische Minerale und dient nicht als Weißpigment. Diese Phase kristallisiert in der Raumgruppe 61, Pbca [5] (Hermann-Mauguin). Auch Brookit geht unterhalb des Schmelzpunktes in Rutil über.
Da die natürlichen Vorkommen störende Färbungen aufweisen, die z. B. durch Eisen im Ilmenit (FeTiO3) hervorgerufen werden, werden diese im Sulfatverfahren oder Chloridverfahren (bevorzugt) raffiniert.
Gewinnung und Darstellung
Durch Solvolyse (Hydrolyse) der Ti(IV)-Verbindung:
Bei der Herstellung von Titanoxid aus Ilmenit nach dem Sulfatverfahren entsteht Dünnsäure (verdünnte Schwefelsäure), die meist nach Aufkonzentration für den Ilmenit-Aufschluss wiederverwendet wird. In einigen Ländern wird diese Dünnsäure bis heute zum Teil in Flüsse und Meere geleitet oder verklappt.
Die Gewinnung nach dem Chloridverfahren, vorwiegend aus Rutil oder TiO2-Schlacke, lässt dagegen keine Dünnsäure entstehen. Das verwendete Chlor bleibt weitgehend im Prozesskreislauf.
Eigenschaften
Der Schmelzpunkt von Titandioxid liegt bei 1855 °C. Es ist thermisch stabil, beständig, hat einen hohen Brechungsindex (2,8) und daher ein großes Färbe- und Deckvermögen. Titandioxid ist chemisch sehr inert. Es ist lichtbeständig, preiswert, bisherigen Untersuchungen zu Folge ungiftig und daher das bedeutendste Weißpigment.
Aus koloristischer Sicht hat Titandioxid das höchste Deckvermögen aller Weißpigmente und gleichzeitig ein hervorragendes Aufhellungsvermögen. Das teilchengrößenabhängige Maximum des Deckvermögens von Rutil liegt bei einer Teilchengröße von etwa 550 nm.[6]
Verwendung
Titandioxid findet überwiegend als weißes Pigment Verwendung und ist im Colour Index unter C.I. Pigment White 6 bzw. C.I. 77891 aufgeführt.
Es ist chemisch stabil, ungiftig und unter der Kennzeichnung E 171 als Lebensmittelzusatzstoff beispielsweise in Zahnpasta und Hustenbonbons anzutreffen, sowie unter CI 77891 als Pigment in Kosmetika. Auch in der Ölmalerei findet es teilweise Verwendung. Im technischen Bereich findet es Verwendung in Farben und Lacken, Textilien, in Papier, sowie als UV-Blocker in Sonnencremes und Aufheller in Arzneimitteln (Tabletten).
Auf den Halbleitereigenschaften des Titandioxids basiert die Farbstoffsolarzelle (Grätzel-Zelle). Mit Hilfe von Titandioxid gelang die Herstellung von Memristoren[7].
Titandioxid wird ebenfalls als Hauptbestandteil des Keramik-Dielektrikums in Klasse 1 Keramikkondensatoren eingesetzt.
Titandioxid in der Anatas-Modifikation ist Hauptbestandteil der Katalysatoren, die für die industrielle Entstickung von Rauchgasen nach dem SCR-Verfahren eingesetzt werden.
TiO2 wird auch im Bereich der Veredlung von Fliesen oder in Putzen verwendet, was dazu führt, dass die damit behandelten Oberflächen schmutzabweisend werden.[8]
Der photokatalytische Effekt von TiO2-Nanopartikeln wird in Verbindung mit der UV-Aktivität für „selbstreinigende“ Oberflächen genutzt (photokatalytische Selbstreinigung). In einer speziellen Einarbeitung in Farben soll das TiO2 bei Lichteinfall aktiv bleiben. Damit dient der photokatalytische Mechanismus des Ti(III)O+/Ti(IV)O2 neben der Oberflächenreinigung auch der Luftreinhaltung. So kann in belasteter Zimmerluft oder an vielbefahrenen Straßen durch Schadstoffzersetzung eine geringfügige Verbesserung der Atemluft erreicht werden.[9]
Eine Möglichkeit, Fasern aus Wolle, Baumwolle oder Hanf mit dieser Reinigungswirkung zu versehen wurde durch die Kopplung über Carboxyl-Gruppen erreicht. Somit ist es möglich Textilien durch Hydroxyl-Radikale gegen Flecke und gegen Krankheitskeime zu schützen. Im Experiment der australischen Forscher waren selbst Rotweinflecke nach 20 Stunden Sonnenlicht beseitigt.[10]
Nachweis
In der Kälte frisch gefälltes Titandioxid ist amphoter und in verdünnten Mineralsäuren löslich. Ein Aufschluss erfolgt mit Kaliumhydrogensulfat im Porzellantiegel. Anschließend wird in kaltem Wasser mit etwas Schwefelsäure gelöst. Mit einigen Tropfen Wasserstoffperoxid bildet sich das gelbe (basisch) bis gelborange (sauer, Foto) [Ti(O2)·aq]2+-Kation. Mit Salzsäure und Zink(granalie) bildet sich naszierender Wasserstoff, der Ti(IV) zu rotviolettem [Ti(H2O)6]3+ reduziert.
Ein weiterer Nachweis ist das organische Reagenz Titangelb.
Siehe auch
Einzelnachweise
- ↑ a b c d Eintrag zu Titan(IV)-oxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 29. November 2007 (JavaScript erforderlich)
- ↑ Studie von TZ Minerals International auf www.tradingmarkets.com
- ↑ T. Brock, M. Groteklaes, P. Mischke; Lehrbuch der Lacktechnologie; 2. Auflage; Seite 123; Vincentz Network; Hannover; 2000; ISBN 3878705697
- ↑ Bericht auf www.purchasing.com
- ↑ a b c Kristallstruktur-Datenbank des Center for Computational Materials Science des U.S. Naval Research Laboratory
- ↑ J. Winkler; Titandioxid; Vincentz Network; Hannover; 2003; ISBN 387870738X
- ↑ Die Neuverdrahtung der Elektronik - Neuverdrahtung der Elektronik
- ↑ Susanne Donner: Putzen mit der Kraft des Lichts. In: Technology Review, Nr. 7, Juli 2006, 19ff.
- ↑ Die Farbe, die für Frischluft sorgt
- ↑ Flecken und Erreger verschwinden durch Sonnenlicht
Weblinks
- Photokatalytische Selbstreinigung am Beispiel der Abwasseraufbereitung Dissertation: Physikalisch-chemische Untersuchungen zur Mineralisierung pharmazeutischer Wirkstoffe an Titandioxid
- Titandioxid in der Wandfarbe reinigt Büroluft Pressemitteilung der Universität Erlangen-Nürnberg im Informationsdienst Wissenschaft
- Titandioxid-MAK-Einstufung: Krebserzeugend Kategorie 3A
Wikimedia Foundation.