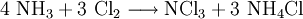- Trichloramin
-
Strukturformel 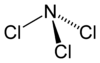
Allgemeines Name Stickstofftrichlorid Andere Namen Trichloramin
Summenformel NCl3 CAS-Nummer 10025-85-1 Kurzbeschreibung gelbe, ölige Flüssigkeit mit starkem Geruch Eigenschaften Molare Masse 120,36 g·mol−1 Aggregatzustand flüssig
Dichte 1,635 g·cm−3[1]
Schmelzpunkt −40 °C[2]
Siedepunkt 71 °C[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [3][4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Stickstofftrichlorid ist eine explosive chemische Verbindung, die zur Gruppe der Stickstoffhalogenide gehört.
Inhaltsverzeichnis
Geschichte
1811 experimentierte der französische Chemiker Pierre Louis Dulong mit Chlorgas und einer Lösung von Ammoniumchlorid, wobei sich Stickstofftrichlorid bildete. Bei seinen Experimenten mit der gefährlichen Verbindung kam es zu einer Explosion, bei der Dulong drei Finger verlor, was ihn jedoch nicht davon abhielt, den Stoff weiter zu untersuchen. Nach dem Bekanntwerden des Unfalls beschäftigte sich 1813 auch der britische Chemiker Humphry Davy mit der Substanz. Später wurden andere Herstellungsverfahren von Balard, sowie Böttger und Kolbe gefunden.[7]
Vorkommen
Bei der Desinfektion mit Chlor in Schwimmbädern entsteht durch die Reaktion mit Harnstoff aus menschlichen Ausscheidungen als Nebenprodukt Stickstofftrichlorid[8].
Gewinnung und Darstellung
Stickstofftrichlorid wird durch Chlorieren einer gesättigten, sauren Ammoniumchlorid-Lösung gebildet, wobei als Zwischenprodukte Chloramin und Dichloramin entstehen.
Ein etwa 12%ige Lösung von Stickstofftrichlorid ist zugänglich durch Einleiten von Chlor in eine Mischung aus Kohlenstofftetrachlorid in Chloroform mit einer Ammoniumsulfatlösung.[9]
Eigenschaften
Physikalische Eigenschaften
Unter Einwirkung von UV-Strahlung im UVB-Bereich bei 340 nm zersetzt sich Stickstofftrichlorid[10] durch Reaktion mit freien Hydroxidionen:
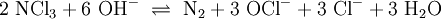
Wie Ammoniak besitzt Stickstofftrichlorid eine pyramidale Molekülstruktur mit einem Cl-N-Cl-Winkel von 107,78° und einer Schenkellänge (N–Cl) von 175,3 pm. Die Standardbildungsenthalpie beträgt +229 kJ/mol[2]Chemische Eigenschaften
Mit Wasser wird Stickstofftrichlorid zu Ammoniak und Hypochlorige Säure (HOCl) hydrolysiert.[11]
Verwendung
Früher diente es zur Bleichung von Mehl, wird aber wegen der Bildung giftiger Stoffen wie Methioninsulfoximid heute dazu nicht mehr eingesetzt.[12]
Sicherheitshinweise
Stickstofftrichlorid reizt die Augen, Atemwege und Schleimhäute[4]. Die endotherme Verbindung explodiert bei Temperaturerhöhung. Lösungen mit einer Konzentration bis zu 18 Prozent gelten als ungefährlich.[9]
Studien aus dem Jahr 1983 mit Ratten zeigten einen LC50-Wert von 112 ppm/1H bei Aufnahme über die Atemwege. Aufgetretene Symptome bei den Tieren waren erhöhter Tränenfluss, Krämpfe und organische und funktionale Störungen der Speicheldrüsen.[5][6]
Quellen
- ↑ webelements.com/NCl3
- ↑ a b c Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Eintrag zu Stickstofftrichlorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 8.1.2008 (JavaScript erforderlich)
- ↑ a b American Industrial Hygiene Association Journal. Vol. 44, Pg. 145, 1983.
- ↑ a b Stickstofftrichlorid bei ChemIDplus
- ↑ Lateral Science: Fulminating oils
- ↑ Gestis: Messverfahren zur Bestimmung von Trichloramin
- ↑ a b G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 479-80.
- ↑ Fachartikel: Energie- und Wassersparkonzepte für Schwimmbäder
- ↑ T. M. Klapötke, H.-J. Meyer, C. Janiak, E. Riedel: Moderne anorganische Chemie, S.75, 2003, Walter de Gruyter, ISBN 3110178389
- ↑ Patrick Otto Ludl: Die Chemie des Stickstoffs und die Rolle seiner Verbindungen für die Chemie der Atmosphäre, ARGE Chemie, Wien, 2003
Wikimedia Foundation.