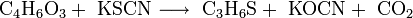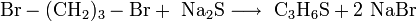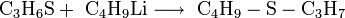- Trimethylensulfid
-
Strukturformel 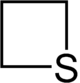
Allgemeines Name Thietan Andere Namen Trimethylensulfid
Summenformel C3H6S CAS-Nummer 287-27-4 Kurzbeschreibung farblose Flüssigkeit [1] Eigenschaften Molare Masse 74,14 g·mol−1 Aggregatzustand flüssig
Dichte 1,03 g·cm–3 (20 °C) [1]
Schmelzpunkt Siedepunkt 92–94 °C [1]
Dampfdruck Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-22 S: 16 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Thietan, auch Trimethylensulfid genannt, ist der einfachste schwefelhaltige gesättigte viergliedrige Heterocyclus.
Inhaltsverzeichnis
Darstellung
Thietan kann in sehr schlechter Ausbeute aus der Reaktion zwischen 1,3-Dioxan-2-on und Kaliumthiocyanat gewonnen werden. Als Nebenprodukte entstehen Kaliumcyanat und Kohlenstoffdioxid.[4]
Ein besserer Syntheseweg ist durch die Reaktion zwischen 1,3-Dibrompropan und Natriumsulfid gegeben.[5]
Eigenschaften
Thietan ist ein farblose Flüssigkeit mit einem Siedebereich von 92–94 °C. Das Molekül ist nicht perfekt quadratisch gebaut sondern besitzt eine verzerrte Struktur. Der Bindungswinkel am Schwefel beträgt 78°, während der gegenüberliegende Kohlenstoff einen Bindungswinkel von 97° aufweist. Die C-S-Bindungslänge beträgt 185,1 pm, die C-C-Bindungslänge 154,9 pm.[6]
Reaktionen
Mit Nukleophilen reagiert Thietan unter Ringöffnung. So bildet sich beispielsweise aus der Umsetzung mit n-BuLi ein unsymmetrischer Thioether.[7]
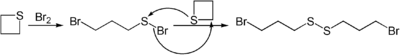
Die Umsetzung mit elementaren Halogenen ermöglicht die Darstellung an beiden Kettenenden halogenierter offenkettiger Disulfide.[8]
Quellen
- ↑ a b c d Sicherheitsdatenblatt Sigma-Aldrich
- ↑ J. R. Meadow, E. E. Reid in: J. Am. Chem. Soc. 1934, 56, 2177–2180. doi:10.1021/ja01325a058
- ↑ D. W. Scott, H. L. Finke, W. N. Hubbard, J. P. McCullough, C. Katz, M. E. Gross, J. F. Messerly, R. E. Pennington, G. Waddington in: J. Am. Chem. Soc. 1953, 75, 2795–2800. doi:10.1021/ja01108a001
- ↑ S. Searles, E. F. Lutz in: A new synthesis of small ring cyclic sulfides J. Am. Chem. Soc. 1958, 80, 3168. doi:10.1021/ja01545a071
- ↑ K. Nagasawa, A. Yoneta in: Chem. Pharm. Bull 1985, 33, 11, 5048–5052. ISSN 0009-2363, [1]
- ↑ Goldish in: J. Chem. Educ. 1959, 36, 408–411. ISSN 0021-9584
- ↑ F. G. Bordwell, H. M. Andersen, M. P. Burnett in:The reaction of thiacyclopropanes and thiacyclobutanes with organolithium compounds J. Am. Chem. Soc. 1954, 76, 1082–1085. doi:10.1021/ja01633a045
- ↑ J. M. Stewart, C. H. Burnside in:Reactions of trimethylenesulfide with chlorine and bromine J. Am. Chem. Soc., 1953, 75, 243–244. doi:10.1021/ja01097a517
Wikimedia Foundation.