- Xenontetroxid
-
Strukturformel 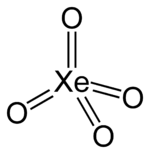
Allgemeines Name Xenon(VIII)-oxid Andere Namen Xenontetroxid
Summenformel XeO4 CAS-Nummer 12340-14-6 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 195,29 g·mol−1 Aggregatzustand gasförmig
Schmelzpunkt Dampfdruck Löslichkeit löslich in Wasser
Dipolmoment 0 D Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Thermodynamische Eigenschaften ΔHf0 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Xenon(VIII)-oxid ist ein Oxid des Edelgases Xenon und damit eine Edelgasverbindung. Es ist ein unter Standardbedingungen farbloses Gas.
Inhaltsverzeichnis
Darstellung
Als Ausgangsstoff für die Herstellung von Xenon(VIII)-oxid dienen Lösungen von Xenaten in der Form HXeO4−. Diese können durch Disproportionierung oder mit Hilfe von Ozon zu Perxenaten der Form HXeO63− oxidiert und als Bariumxenat Ba2XeO6 ausgefällt werden. Daraus kann man mit Hilfe von konzentrierte Schwefelsäure über die instabile Zwischenstufe Perxenonsäure H4XeO6 Xenon(VIII)-oxid gewinnen:
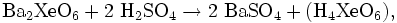
- Bildung der Zwischenstufe
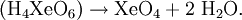
- Bildung des Xenon(VIII)-oxides
Diese Reaktionen werden bei −5 °C durchgeführt, wodurch das Produkt Xenontetroxid als Gas entweicht.
Eigenschaften
Xenon(VIII)-oxid besitzt mit 643 kJ/mol eine positive Bildungsenthalpie und ist somit eine stark endotherme Verbindung. Dadurch neigt es zu explosivem Zerfall unter Bildung elementaren Xenons und Sauerstoffs. Im festem Zustand unterhalb von −39,5 °C liegt es als gelbliche, kristalline Masse von erheblich höherer Stabilität vor.[3] Gelegentlich kann es auch bei tiefen Temperaturen (−40 °C) explodieren, weshalb der Umgang mit Xenontetroxid mit großer Vorsicht erfolgen und bei möglichst tiefen Temperaturen (Stickstoffkühlung) stattfinden muss.
Wässrige Lösung
In wässriger Lösung liegt Xenon(VIII)-oxid in Form von HXeO63−-Ionen vor, die sich von der unbeständigen und nicht isolierbaren Perxenonsäure H4XeO6 ableiten lassen. Der Grund für deren Instabilität liegt in der Zersetzung von Perxenonsäure zu Xenonsäure und Sauerstoff. Die Zersetzung findet im basischen langsam, in sauren sehr schnell statt. Stabil sind hingegen eine größere Zahl von Salzen, die sich von der Perxenonsäure ableiten und Perxenate genannt werden. Beispiele sind Ba2XeO6 oder Na4XeO6
Literatur
- Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007. ISBN 978-3-11-017770-1.
Einzelnachweise
- ↑ a b Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Selig , J. G. Malm , H. H. Claassen , C. L. Chernick, J. L. Huston: Xenon tetroxide – Preparation and Some Properties. In: Science 143, S. 1322 (1964)
Wikimedia Foundation.
