- Xenon(VI)-oxid
-
Strukturformel 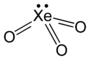
Allgemeines Name Xenon(VI)-oxid Andere Namen Xenontrioxid
Summenformel XeO3 CAS-Nummer 13776-58-4 Kurzbeschreibung weiße, explosive Kristalle[1]
Eigenschaften Molare Masse 179,30 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit gut löslich in Wasser[3]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Xenon(VI)-oxid (Summenformel XeO3) ist eine chemische Verbindung der Elemente Xenon und Sauerstoff. Xenontrioxid ist instabil und neigt zu explosionsartiger Zersetzung. Dies passiert bei etwa 25 °C. Es ist eine der wenigen bekannten Edelgasverbindungen, welche sich in Wasser lösen lassen. Hierbei entsteht im geringen Maß die instabile Xenonsäure (H2XeO4).
Inhaltsverzeichnis
Darstellung
Xenontrioxid lässt sich nicht direkt darstellen, da die Elektronegativität des Sauerstoffs für die direkte Reaktion nicht ausreicht. Daher stellt man zunächst Xenondifluorid her, indem man unter hohem Druck und hoher Temperatur Xenon mit Fluor reagieren lässt. Das Xenondifluorid reagiert dann unter Disproportionierung zu Xenontetrafluorid und Xenon, anschließend zu Xenonhexafluorid und Xenondifluorid. Zuletzt wird durch Umsatz mit Lauge und Calciumsalzen das Fluor in der Verbindung durch Sauerstoff ersetzt, wobei Zwischenprodukte wie Xenontetrafluoridoxid und Xenondifluoriddioxid entstehen.
Typische Reaktionen von Xenontrioxid
- In stark alkalischer Lösung wird ein Hydroxidion (OH−) addiert, so dass HXeO4− entsteht. Dieses HXeO4− disproportioniert allmählich zu Xenat (XeVIII !) und Xenon (Xe0). Es lassen sich sodann Perxenate wie z. B. Na4XeO6 · 6H2O isolieren.
- Durch Zugabe von konz. Schwefelsäure (H2SO4) kann aus den gelben Perxenat-Lösungen (z. B. von Ba2XeO6) das gasförmige, hochexplosive Anhydrid Xenontetroxid (XeO4) gewonnen werden.
- Xenate(+VI), hier in Form von XeO3, und Perxenate(+VIII) gehören zu den stärksten Oxidationsmitteln. (Standardelektrodenpotentiale: E0(Xe/XeO3) = +1,8 V; E0(Xe/XeO64−) = +3,0 V). Sie sind vor allem deshalb von Interesse, weil bei ihrer Reduktion lediglich elementares Xenon entsteht, das wieder aufs neue eingesetzt werden kann.
- quantitative Reduktion von XeO3 durch I−:
- Es gibt (bzw. gab 1992) Hinweise auf die Entstehung von Xenat-Estern bei der heftigen Reaktion von XeO3 mit Alkoholen
- Beim Leiten von Ozon (O3) durch eine verdünnte XeO3-Lösung entstehen Perxenate (Xe+VIII), die stabile Natrium- und Bariumsalze bilden können
Einzelnachweise
- ↑ Helmut Sitzmann, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b www.webelements.com/Xenontrioxid
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin, 2007.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Literatur
- Christen/Meyer: Allgemeine und Anorganische Chemie Bd. II. Frankfurt am Main, 1995
- Hans Rudolf Christen: Grundlagen der Allgemeinen und Anorganischen Chemie. Frankfurt am Main, 1968
- Shriver/Atkins/Langford: Anorganische Chemie. Weinheim, New York, Basel, Cambridge, 1992
- Cotton/Wilkinson: Anorganische Chemie. Weinheim, 1974
Wikimedia Foundation.

