- Zeolith Y
-
Zeolith Y ist eine technisch bedeutsame, künstlich hergestellte kristalline Substanz aus der Stoffgruppe der Zeolithe. Unter den Mineralen hat es seine Entsprechung im Faujasit.
Inhaltsverzeichnis
Geschichte
Nach der Synthese von Zeolith A und Zeolith X mit einem Si/Al-Verhältnis nahe 1 in 1950 durch Robert Milton bei Linde Air Products Division von Union Carbide wurde bemerkt, dass synthetische Zeolithe anfällig gegen Säuren, Wasser oder Dampf aufgrund von Dealuminierung waren.[1] Mordenit, mit einem Si/Al-Verhältnis von 5, ist weniger anfällig. Während der Bemühungen, synthetische Zeolithe mit einem höheren Si/Al-Verhältnis herzustellen, gelang es 1954 Donald Breck, einem Kollegen von Milton bei Union Carbide, Zeolith Y zu synthetisieren. Dieser zeigte, wie erwartet, eine höhere Stabilität. Uytterhoeven et al. bestimmten 1965 als erste den Protonengehalt von HY, der sauren From von Zeolith Y.[2][3] 1967 zeigten George Kerr und seine Mitarbeiter von Mobil und W. R. Grace and Company, dass eine ultrastabile Form von Zeolith Y (USY) durch Erhitzung in einer "inerten statichen Atmosphäre" hergestellt werden konnte. Im selben Jahr veröffentlichte Benesi die ersten thermogravimetrischen Kurven zur thermischen Zersetzung der Ammoniumform von Zeolith Y.[4][3]
Struktur
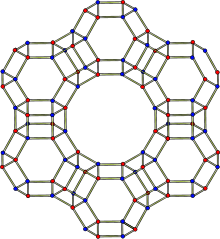
Die Kristallstruktur des Zeolith Y entspricht derjenigen von Faujasit. Das Faujasitgerüst besteht aus Sodalithkäfigen, die über hexagonale Prismen miteinander verbunden sind. Die Poren, die durch den Verbund dieser Sekundärstrukturen gebildet werden, sind senkrecht zueinander angeordnet. Die größte Pore, die durch einen Ring mit 12 Einheiten gebildet wird, hat einen Durchmesser von 7.4 Å und ist damit im Vergleich zu anderen Zeolithen relativ groß. Der Innenraum der großen Kaverne hat einen Durchmesser von 12 Å und ist umgeben von 10 Sodalithkäfigen. Die Zelleinheit ist kubisch mit einer Länge von 24,7 Å.[5] Die Pore, die durch das hexagonale Prisma gebildet wird, hat einen Durchmesser von 2,5 Å und ist damit nur etwa ein Drittel so groß wie die große Pore.[6]
Sodalithkäfige und hexagonale Prismen (Sekundärstrukturen) bilden Elementarzellen (Tertiärstrukturen). Eine Elementarzelle enthält 18 Sodalithkäfige und 16 hexagonale Prismen. Eine solche Elementarzelle hat die Zusammensetzung Na58Al58Si134 * 240 H2O.
Zeolith Y der Na-Form enthält 52 Natriumionen pro Elementarzelle, davon 16 innerhalb der hexagonalen Prismen und der Sodalithkäfigen.[7] Die Natriumionen in den hexagonalen Prismen sind mit 6 Sauerstoffionen aus dem Zeolithgerüst koordiniert. In diesen Prismen gibt es keinen weiteren Platz für Wassermolekülen, so dass die Natriumionen mit den Sauerstoffionen des Zeolithgerüstes koordinieren. In den Sodalithkäfigen sind sie mit 3 Sauerstoffionen aus dem Zeolithgerüst und zwei Wassermolekülen koordiniert. Die restlichen 36 Natriumionen befinden sich in den Superkäfigen und sind mit 6.5 Molekülen Wasser vollständig hydratisiert. Diese Natriumionen sind mobil und verhalten sich wie in einer wässrigen Lösung.
Das Si/Al-Verhältnis beträgt 2,43 und der Leervolumenanteil 48 %.[8]
Faujasit-Materialien zeichnen sich durch eine große Oberfläche und eine enge Porenverteilung im Bereich von 0.9 bis 1.2 nm, sowie durch eine hohe thermische Beständigkeit aus.[9] Zeolith Y zersetzt sich ab 793 °C.[5]
Formen
Je nach Gegenion am Aluminium wird nach "Formen" unterschieden:
- NaY ist die ursprüngliche Form mit Natrium.
- HY ist die natriumfreie, in den sauren Zustand überführte Form. Diese Bezeichnung wurde 1969 von Kerr et al. eingeführt.[10][3]
- NH4Y ist die Form mit Ammonium als Gegenion. Durch Kalzinierung entsteht daraus HY.
Weiterhin unterscheidet man nach der Stabilität:
- USY für ultrastabiler Zeolith Y (ultra stable), der durch Kalzinierung bei hohen Temperaturen gewonnen wird
- VUSY für very ultrastable
Synthese
Kristallisation
Zeolith Y wird - wie auch andere Zeolithe - durch Kristallisation aus Aluminium (z.B. Natriumaluminate) und Silicium enthaltenden Stoffen (z.B. Natriumsilikate oder Wasserglas) hergestellt. Auch andere Alumosilikate wie Kaolin können als Aluminium- und Siliciumquellen dienen. Die Edukte werden in einem alkalischen Medium, z.B. Natronlauge, bei Temperaturen zwischen 70 und 300°C (meistens um 100°C) gelöst und kristallisiert. Dabei handelt es sich nicht um eine Kristallisation im klassischen Sinne, bei der die Löslichkeitsgrenze eines gelösten Stoffes überschritten wird, so dass dieser in den festen Zustand übergeht, sondern vielmehr um eine chemische Reaktion, bei der die einzelnen Komponenten (Aluminate und Silikate) in Form eines Kristallgitters zusammengefügt werden.
Ionentausch
Nach der Synthese liegt der Zeolith in seiner Natriumform vor, d.h. die Gegenionen der Aluminiumionen bestehen aus Natriumkationen. Er wird durch Ionentausch mit Ammoniumsalzen (z.B. Ammoniumnitrat oder Ammoniumsulfat) in die Ammoniumform überführt. Die Natriumkationen werden durch Ammoniumkationen ersetzt und gelangen in die Mutterlauge. Der Ionentausch kann beispielsweise durch Rühren in Behältern unter Zugabe der Ammoniumsalzlösung durchgeführt werden.
Die Natriumkationen in den Superkäfigen können leicht ausgetauscht werden, da sie hydratisiert und mobil sind. Die Natriumionen in den hexagonalen Prismen sind dagegen mit den Sauerstoffionen des Zeolithgerüstes koordiniert und daher nur schwer zugänglich. Sie lassen sich nicht ohne weiteres ionenaustauschen.
Um die Zeolithstruktur zu stabilisieren, wird in der Regel ein Teil des Natriums durch Seltenerdmetalle, meistens Lanthan, teilweise auch Cer, ebenfalls durch Ionentausch ersetzt. Der Ersatz des einwertigen Natriumions durch zwei- oder dreiwertige Kationen führt zu einer Erhöhung der Gitterenergie und erhöht dadurch die Strukturstabilität.[11] Bei 25 °C sind die hydratisierten Lanthanionen zu groß, um von den Superkäfigen in die hexagonalen Prismen diffundieren zu können.[12] Die hexagonalen Prismen haben einen freien Durchmesser von 0.25 nm, während die hydratisierten La3+-Ionen mit 0.396 nm größer sind. Damit Lanthan in die kleinen Sodalithkäfigen durch die hexagonalen Prismen diffundieren kann, muss die Hydrathülle durch Kalzinierung entfernt werden.
Kalzinierung
Durch anschließende Kalzinierung wird das Ammoniumion entfernt und der Zeolith in seine saure Form überführt. In der sogenannten Ultrastabilisierung wird der Zeolith bei 700°C bis 800°C mit Wasserdampf behandelt.[8] Dabei verliert der Zeolith Aluminium und die spezifische Oberfläche geht zurück.
Durch die Kalzinierung verlieren die Gegenkationen, speziell Natrium oder Lanthan, ihre Hydrathüllen. Dadurch können sie durch die hexagonalen Prismen in die kleineren Sodalithkäfigen diffundieren. So können beispielsweise Lanthanionen ab Temperaturen um 100°C in die Sodalithkäfige diffundieren.[12] Bei Temperaturen von höher als 200°C in Gegenwart von Lanthan, bildet sich an jedem Lanthanion eine Hydroxylgruppe und ein Proton. Die dadurch gebildete Säure führt zu einer Dealuminierung des Gitters.
Dealuminierung
Das atomare Verhältnis Si/Al in Zeolithen stellt einen wichtigen Parameter dar, der solche Eigenschaften wie maximale Ionentauschfähigkeit, thermische und hydrothermale Stabilität, Hydrophobizität, sowie Anzahl und Stärke der brönstedsauren Zentren definiert. Zeolithe mit einem niedrigen Aluminiumgehalt sind in der Regel stabiler, vor allem wenn sie als FCC-Katalysatoren verwendet werden. Da die Synthese von Zeolith Y nur in einem engen Si/Al-Bereich ohne größeren Aufwand gelingt, kann dieser nicht mit einem Si/Al-Verhältnis größer als 2.5 direkt durch Kristallisation hergestellt werden.[13] Das Si/Al-Verhältnis kann jedoch durch spätere Entfernung von Aluminium aus dem Gitter erhöht werden. Dies führt zu Gitterfehlstellen, die teilweise durch Einbau anderer Elemente, insbesondere Silizium, erneut besetzt werden können. Es gibt verschiedene Dealuminierungsverfahren, wovon die wichtigsten die folgenden sind:
- Säurebehandlung
- Hydrothermale Behandlung (mit heissem Wasserdampf)
- Behandlung mit gasförmigen Halogenen
Durch den Wegfall der AlO2-Gruppen verringert sich die Anzahl an (Natrium-) Gegenkationen. Dies verringert auch die maximal mögliche Beladung mit Metallen der seltenen Erden.
Eigenschaften
Stabilität
Zeolith Y der H-Form, der durch Kalzinierung der Ammoniumform gewonnen wird, ist in Gegenwart von Wasser sehr instabil.[13] Diese Instabilität wurde auf die intrinsische Acidität dieser Form zurückgeführt, wenn Gitter-Wasserstoffionen mit interkristallinem, "flüssigem" Wasser H3O+-Ionen bilden. Dies führt zu einer Dealuminierung des Gitters ähnlich der, die durch eine Behandlung mit Säure entsteht.
Die thermische Stabilität des Zeolithgitters hängt wesentlich von dem Gegenkation am Aluminium, dessen Verteilung im Gitter und dem Grad an Ionentausch.[11] Ionentausch mit multivalenten Kationen, insbesondere die der Metalle der seltenen Erden, erhöhen die thermische Stabilität von Zeolith Y (siehe Synthese und Ionentausch).
Verwendung
Zeolith Y wird vor allem als Crack-Katalysator im FCC-Verfahren zur Umwandlung von Rückständen in Diesel oder Benzin in der Raffinerie verwendet. Zeolith Y hat Zeolith X als Katalysator verdrängt, da es aufgrund seines höheren Si/Al-Verhältnisses eine höhere Stabilität aufweist und außerdem aktiver ist. Er findet auch im Hydrocracking-Verfahren Verwendung als Träger für Platin/Palladium, um den Gehalt an Aromaten zu erhöhen.
Einzelnachweise
- ↑ Masters, A.; Maschmeyer, Th.: Zeolites - From curiosity to cornerstone, Microporous and Mesoporous Materials 142 (2011) 423-438
- ↑ Uytterhoeven, J.B., Christner, L.G., Hall, W.K.; J. Phys. Chem. (1965) 69,2117
- ↑ a b c Kerr, G.T., Hydrogen Zeolite Y, Ultrastable Zeolite Y, and Aluminum-Deficient Zeolites, Advances in Chemistry Series, 121/219-229, 1973
- ↑ Benesi, H.A., J. Catal. (1967) 8, 368
- ↑ a b The Chemical Engineering Zeolite Page
- ↑ Breck, D.W., Zeolite Molecular Sieves, 1974, Wiley & Sons
- ↑ Marinsky, J.A., Ion Exchange, Volume 2, 169, Dekker Inc.
- ↑ a b "Synthese und katalytische Charakterisierung von Zeolith Y mit untereschiedlicher Kristallgröße", Dissertation von Christine Berger
- ↑ Karami, D.; Rohani, S.; Synthesis of pure zeolite Y using soluble silicate, a two-level factorial experimental design, Chem. Eng. and Proc. 28 (2009) 1288-1292.
- ↑ Kerr, G.T., Cattanach, J., Wu, E.L.; J. Catal. (1969) 13, 114.
- ↑ a b Shiralkar, V.P., Kulkarni, S.B., Thermal and structural properties of rare earth exchanged zeolites, Journal of Thermal Analysis, Vol. 25, (1982), pp. 399-407
- ↑ a b Lee, E.F.T., Rees, V.C., Effect of calcination on location and valency of lanthanum ions in zeolite Y, Zeolites, 1987, Vol. 7, pp. 143-147
- ↑ a b Beyer, H.K.: Dealumination Techniques for Zeolites, Molecular Sieves - Post-Synthesis Modification I, Springer Verlag, 2002, S. 204-255
Literatur
- Subhash Bhatia: Zeolite Catalysis. Principles and Applications. CRC Press Inc., Boca Raton FL 1990, ISBN 0-8493-5628-8.
- F. Ramoa Ribeiro u. a. (Hrsg.): Zeolites. Science and Technology. Proceedings of the NATO Advanced Study Institute on Zeolites, Science and Technology, Alcabideche, Portugal, May 1 – 12, 1983. Martinus Nijhoff Publishers u. a., The Hague u. a. 1984, ISBN 90-247-2935-1 (NATO ASI series: E: Applied sciences 80).
Weblinks
- "Synthese und katalytische Charakterisierung von Zeolith Y mit untereschiedlicher Kristallgröße", Dissertation von Christine Berger
- The Chemical Engineering Zeolite Page
- James A. Kaduk, Johan Faber: Crystal Structure of Zeolite Y as Function of Ion Exchange. The Rigaku Journal, Vol. 12, No. 2, 1995
Kategorien:- Katalysator
- Natriumverbindung
- Aluminiumverbindung
- Siliciumverbindung
- Calciumverbindung
- Magnesiumverbindung
- Sauerstoffverbindung
Wikimedia Foundation.