- Γ-Aminobuttersäure
-
Strukturformel 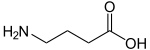
Allgemeines Name γ-Aminobuttersäure Andere Namen - 4-Aminobuttersäure
- Piperidinsäure
- γ-Aminobutansäure
- γ-Aminobutyrat
- GABA
Summenformel C4H9NO2 CAS-Nummer 56-12-2 PubChem 119 Eigenschaften Molare Masse 103,12 g·mol−1 Aggregatzustand fest
Schmelzpunkt 203 °C (Zersetzung) [1]
pKs-Wert 4,0459 [1]
Löslichkeit gut löslich in Wasser: 1300 g·l−1 (25 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 LD50 12.680 mg·kg−1 (Maus, peroral) [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die γ-Aminobuttersäure (GABA) ist das biogene Amin der Glutaminsäure und der wichtigste inhibitorische (hemmende) Neurotransmitter im Zentralnervensystem. Chemisch strukturell ist sie eine nichtproteinogene Aminosäure. Von den proteinogenen (d. h. in Proteinen vorkommenden) α-Aminosäuren unterscheidet sie sich in der Regioposition der Aminogruppe relativ zur Carboxylgruppe: GABA ist eine sogenannte γ-Aminosäure, da sich die Aminogruppe am dritten Kohlenstoffatom nach dem Carboxyl-Kohlenstoffatom befindet. Bei α-Aminosäuren befindet sich die Aminogruppe am ersten Kohlenstoffatom nach dem Carboxyl-Kohlenstoffatom.
Inhaltsverzeichnis
Rezeptoren
GABA bindet an spezifische Rezeptoren. Es gibt ionotrope und metabotrope GABA-Rezeptoren:
- der GABAA-Rezeptor ist ein ligandengesteuerter Chloridionenkanal (ionotrop), der sich öffnet und ein inhibitorisches Signal auslöst, sobald GABA an ihn bindet.
- der GABAB-Rezeptor gehört zu den G-Protein-gekoppelten Rezeptoren (metabotrop). Er vermittelt eine erhöhte Öffnungswarscheinlichkeit von Kaliumkanälen. Dies führt zur Hyperpolarisation der Zellmembran. Weiterhin wird die Offenwahrscheinlichkeit für Calciumkanäle vermindert. Dieser Effekt macht sich hauptsächlich präsynaptisch bemerkbar, hier wird die Transmitter-Ausschüttung gehemmt.
- der GABAC-Rezeptor ist ein ionotroper Rezeptor. Er unterscheidet sich vom GABAA-Rezeptor dadurch, dass viele pharmakologische Substanzen wie Benzodiazepine und Barbiturate an diesem Rezeptor unwirksam sind.
Biosynthese und Metabolismus
GABA wird mit Hilfe der Glutamat-Decarboxylase (GAD) aus Glutamat synthetisiert. In einem Schritt wird also aus dem wichtigsten exzitatorischen der wichtigste inhibitorische Neurotransmitter. GABA wird zum Teil in benachbarte Gliazellen transportiert. Dort wird es durch die GABA-Transaminase zu Succinat-Semialdehyd umgewandelt und kann so in den Citratzyklus eingeschleust werden.
GABA-Rezeptoren kommen auch häufig an der präsynaptischen Zelle vor, was zu einer präsynaptischen Hemmung führt. Der Neurotransmitter GABA kann nach seiner Verwendung entweder wieder in die präsynaptische Zelle aufgenommen und in Vesikeln gespeichert werden, oder durch die GABA-Transaminase metabolisiert, oder im Glutaminzyklus in Gliazellen weiterverarbeitet werden.
GABA-Rezeptoren spielen auch bei der Hirnentwicklung eine wichtige Rolle. Interessanterweise wirkt GABA beim Fötus exzitatorisch und ist essentiell für die Etablierung neuronaler Verbindungen.
Rolle von GABA in der Bauchspeicheldrüse
GABA ist als inhibitorischer Neurotransmitter bekannt. In verschiedenen endokrinen Zellen hemmt GABA die Hormonsekretion, indem es die Zellmembran hyperpolarisiert. Bedeutendste Wirkung in der Bauchspeicheldrüse ist die Hemmung der Glucagonsekretion der Alphazellen der Langerhans-Inseln.
Synthese und Sekretion
In der insulinbildenden Betazelle der Langerhans-Inseln der Bauchspeicheldrüse wird durch das Enzym GAD65 (Glutamat-Decarboxylase) und die Isoform GAD67 aus Glutamat GABA gebildet. Die Betazelle sezerniert GABA über drei Systeme: Über SLMV (synaptic-like-microvesicles, welche synaptischen Vesikeln ähneln), über einen geringen Teil der LDCV (large dense core vesicles, welche den Insulin-Zink-Komplex enthalten), und wahrscheinlich zusätzlich über (unspezifische?) Transportsysteme der Plasmamembran für organische Säuren und Aminosäuren.
Die jeweiligen Vesikel verfügen über einen GABA-Transporter (VIAAT/VGAT) und eine vakuoläre H+-ATPase, welche durch Protonentransport in die Granule hinein (Ansäuerung) einen elektrochemischen Gradienten aufbaut und damit den Antrieb für die Beladung der Granule bildet.
Regulation
Die GABA-Sekretion ist zunächst konstitutiv (alle vier Stunden wird der Gesamtbestand sezerniert). Zusätzlich erfolgt die vesikuläre Sekretion, die ähnlich wie die des Insulins durch Calciumeinstrom reguliert wird (10 % der LDCV Insulingranulen enthalten GABA; die SLMV werden ebenfalls auf einen Calciumeinstrom hin sezerniert). Die Menge der sezernierbaren GABA wird u. a. durch cAMP/PKA reguliert (Stimulation des Systems z. B. durch Glucagon-like Peptid 1 (GLP1)), indem GAD67 induziert wird, und allen physiologischen Konzepten entgegen eher verringert durch Glucose, da GABA über den sog. GABA shunt in den Mitochondrien verstoffwechselt wird. Das limitierende Enzym ist die GABA-Transaminase GABA-T.
Wirkung
Die sezernierte GABA befindet sich im Zellzwischenraum und gelangt durch Diffusion oder über den regulären Kapillarfluss zum Inselmantel. Dort erreicht sie die glucagonproduzierenden Alphazellen.
Die Alphazellen verfügen über einen ionotropen GABAA-Rezeptor. Dessen Aktivierung bewirkt einen Chlorideinstrom und die Hyperpolarisation der Plasmamembran und somit die Hemmung der Glucagonsekretion.
Physiologie
Ein altes Konzept besagt, dass Glucose die Glucagonsekretion hemmt. Ein hierbei relevantes Prinzip ist, dass durch Glucose die Anzahl der GABAA-Rezeptoren auf der Alphazelle erhöht wird. GABA ist in hoher Konzentration (konstitutionell) vorhanden. Etwa 30 % des Glucoseeffektes lassen sich somit über GABA erklären. GABA hat auf die Betazelle keinen rezeptorvermittelten Effekt; die Somatostatinsekretion der Deltazelle wird ebenfalls inhibiert.
Klinischer Ausblick
Man versucht, die erhöhte Glucagonbildung des Diabetikers durch einen Mangel an GABA (durch ausbleibende Synthese bei fehlenden oder erschöpften Betazellen) zu erklären. Es existiert die Vorstellung einer durch den GABAA-Rezeptor vermittelten Suppression der Aktivität der T-Lymphozyten.
Einzelnachweise
Literatur
- H. Lüllmann, K. Mohr, M. Wehling: Pharmakologie und Toxikologie. 15. Auflage, Thieme Verlag, 2003, ISBN 3-13-368515-5
- Klaus Aktories, Ulrich Förstermann, Franz Hofmann, Wolfgang Forth: Allgemeine und spezielle Pharmakologie und Toxikologie. 9., Auflage. Urban & Fischer Bei Elsevier, 2004, ISBN 3437425218.
- M. Robert Julien: Drogen und Psychopharmaka. Spektrum Akademischer Verlag, 1934, ISBN 3-8274-0044-9
Siehe auch
- α-Aminobuttersäure
- β-Aminobuttersäure
Weblinks
Wikimedia Foundation.
