- Cadmiumdiiodid
-
Kristallstruktur 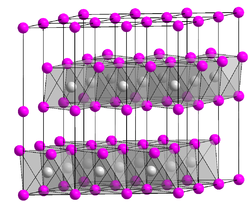
__ Cd2+ __ I- Allgemeines Name Cadmiumiodid Andere Namen - Cadmium(II)-iodid
- Cadmiumdiiodid
Verhältnisformel CdI2 CAS-Nummer 7790-80-9 Kurzbeschreibung farbloser bis leicht gelblicher Feststoff Eigenschaften Molare Masse 366,22 g·mol−1 Aggregatzustand fest
Dichte 5,670 g·cm−3 (30 °C)[1]
Schmelzpunkt 387 °C[1]
Siedepunkt 796 °C[1]
Dampfdruck 0,13 mbar (402 °C)[1]
Löslichkeit 1850 g·l−1 in Wasser (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23/25-33-68-50/53 S: (1/2)-22-45-60-61 MAK aufgehoben, da cancerogen [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Der farblose Feststoff Cadmiumiodid, CdI2, ist eine chemische Verbindung des Nebengruppenelements Cadmium mit Iod. Aufgrund seiner besonderen Schichtstruktur ist es weniger salzartig als die Verbindungen des Typs CdX2 mit den leichteren Halogenen Fluor und Chlor. CdI2 ist der Prototyp einer AB2-Struktur mit hexagonal-dichtester Kugelpackung.
Inhaltsverzeichnis
Darstellung
Die Darstellung von Cadmiumiodid gelingt aus den Elementen bei erhöhter Temperatur oder durch die Reaktion von Iodwasserstoff in wässriger Lösung mit Cadmium oder Cadmiumcarbonat. In letzterem Fall entsteht ein Hydrat, das mit Thionylchlorid behandelt wird, um wasserfreies CdI2 zu erhalten.
Cadmiumiodid-Struktur
Die Iodidionen I− bilden eine hexagonal-dichteste Kugelpackung, in der jede zweite Oktaederlückenschicht vollständig mit Cadmiumionen Cd2+ besetzt ist. Die Cadmiumionen sind oktaedrisch von sechs Iodidionen umgeben, wobei jedes Iodidion die Spitze einer trigonalen Pyramide mit drei Cadmiumionen als Grundfläche bildet (Koordination = 6:3). Daraus resultiert eine Schichtgitterstruktur, die in einer Reihe von anorganischen Salzen und Mineralien vorhanden ist. Der Bindungstyp für Cd-I ist ionisch mit kovalentem Bindungsanteil, wohingegen die Iodidschichten nur durch schwache Van-der-Waals-Kräfte zusammengehalten werden. Die CdI2-Struktur besitzt in der trigonalen Raumgruppe
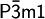 eine Elementarzelle mit den Zellkonstanten a = b = 4.24 Å, c = 6.84 Å, α = β = 90° und γ = 120°, wobei die Schichtfolge ABAB ist. Der stabilste Polytyp kristallisiert in der hexagonalen Raumgruppe
eine Elementarzelle mit den Zellkonstanten a = b = 4.24 Å, c = 6.84 Å, α = β = 90° und γ = 120°, wobei die Schichtfolge ABAB ist. Der stabilste Polytyp kristallisiert in der hexagonalen Raumgruppe 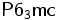 und weist die Zellkonstanten a = b = 4.24 Å, c = 13.67 Å, α = β = 90° und γ = 120° auf. Die Schichtabfolge der Iodidionen ist in diesem Fall ABCB, jedoch kann Cadmiumiodid auch mit anderer Schichtenanordnung (z. B. ABCACB) in den trigonalen Raumgruppen
und weist die Zellkonstanten a = b = 4.24 Å, c = 13.67 Å, α = β = 90° und γ = 120° auf. Die Schichtabfolge der Iodidionen ist in diesem Fall ABCB, jedoch kann Cadmiumiodid auch mit anderer Schichtenanordnung (z. B. ABCACB) in den trigonalen Raumgruppen 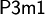 ,
, 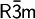 und
und 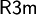 existieren (siehe Weblinks).
existieren (siehe Weblinks).Folgende Verbindungen nehmen als Feststoffe die CdI2-Struktur an, die als der entsprechende Prototyp gilt:
- Iodide wenig polarisierender Kationen, sowie Bromide und Chloride stärker polariserender Kationen
- Hydroxide von Dikationen M2+ der allgemeinen Formel M(OH)2
- Sulfide, Selenide und Tellurid von Metallionen M4+ der allgemeinen Formel MX4 mit X = S, Se, Te
Verbindungen des CdI2-Typs
Iodide
Bromide
Chloride
Hydroxide von M2+
Chalkogenide von M4+
Fluoride und Carbide
Ag2F und W2C gehören zum anti-CdI2-Typ mit großen Metallkationen auf den Iodid-Positionen, während die Anionen die Oktaederlücken besetzen.
Eigenschaften und Verwendung
Cadmiumiodid bildet an Luft stabile, weiß glänzende, hexagonale Plättchen, die bedingt durch die Schichtstruktur leicht spaltbar sind. Eine relativ neu entdeckte Modifikation des Cadmiumiodids sind die gut charakterisierten Nanopartikel, die CdI2 bei der Bestrahlung mit Elektronen bildet, wobei Nanoröhren und Fulleren-artige Strukturen entstehen (siehe Weblinks). Mit Iodiden können die Halogenokomplexe CdI3− und CdI42− erhalten werden. In konzentrierter Lösung bildet Cadmium(II)-iodid eine Komplexverbindung der Formel Cd[CdI4]. Formal handelt es sich um Cadmium(II)-tetraiodocadmat(II). Dieses Verhalten, das auch als Autokomplex-Bildung bezeichnet wird, beobachtet man auch bei Cadmiumchlorid und -bromid. Cadmiumiodid findet im chemischen Labor Verwendung, sowie in der Industrie bei der Herstellung chemischer Feinprodukte (z. B. Leuchtfarben). Es wird auch bei photographischen Verfahren wie der Ferrotypie eingesetzt.
Sicherheitshinweise
Cadmiumiodid ist giftig beim Einatmen und Verschlucken, besitzt chronische Toxizität und wirkt krebserregend in Tierversuchen. Die letale Dosis LD50 beträgt bei Mäusen 166 mg/kg. Als niedrigste bekannte tödliche Dosis bei oraler Aufnahme durch den Menschen (LDLo) werden 81 mg/kg angegeben. Außerdem ist die Öko-Giftigkeit von Cadmiumiodid sehr hoch, insbesondere für Wasserorganismen, zumal es in Gewässern langfristige Schäden hervorrufen kann.
Quellen
- ↑ a b c d e f Eintrag zu Cadmium(II)-iodid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 2.1.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7790-80-9 im European chemical Substances Information System ESIS
Literatur
- Holleman-Wiberg. Lehrbuch der Anorganischen Chemie. 101. Auflage. Berlin, New York: De Gruyter 1995. ISBN 3-11-01-2641-9
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
Weblinks
- Interaktive Kristallstrukturseite (englisch, weitgehend selbsterklärend)
- Varianten im Schichtenaufbau von CdI2 (eng.)
- CdI2-Nanostrukturen (eng.)
- Sicherheitsdatenblatt
Wikimedia Foundation.
