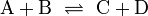- Chemische Reaktionsart
-
Eine chemische Reaktion ist ein Vorgang bei dem chemische Spezies ineinander umgewandelt werden,[1] bzw. genauer: bei dem aus einem oder mehreren „Edukten“ (auch „Reaktant“ bzw. „Reaktanten“ genannt), ein oder mehrere „Produkte“ entstehen. Dabei wird von den Edukten Energie abgegeben oder aufgenommen. Das Produkt bzw. die Produkte haben andere chemische und physikalische Eigenschaften als das Edukt bzw. die Edukte. Die gezielte Herstellung von Produkten mit gewünschten Eigenschaften ist die Hauptaufgabe der chemischen Industrie.
Grundlagen
Ursache für die Änderung der Eigenschaften ist die bei einer chemischen Reaktion erfolgende Umordnung von Atomen, manchmal auch geladenen Atomen (Ionen), und die daraus resultierende Änderung der Bindungsverhältnisse zwischen Atomen bzw. geladenen Atomen. Letzteres hat zusätzlich zur Folge, dass bei einer chemischen Reaktion ein Energieumsatz erfolgt. Dieser wird als Reaktionsenthalpie bezeichnet. Wird Energie von den reagierenden Stoffen abgegeben spricht man von einer exothermen Reaktion. Bei einer endothermen Reaktion wird von den reagierenden Stoffen Energie aufgenommen. Eine chemische Reaktion unterliegt dabei immer den Gesetzen der Massenerhaltung, der Energieerhaltung und der Entropie.
Ob eine chemische Reaktion in der Realität überhaupt ablaufen kann, hängt von mehreren Faktoren ab. Entscheidend sind das Vorliegen der richtigen Edukte und der richtigen Reaktionsbedingungen (z. B. Reinheit und Zerteilungsgrad der Edukte sowie Druck, Temperatur, usw.) - siehe #Statistische Betrachtungen und #Energetische Betrachtungen.
Oft muss zum Starten der Reaktion Aktivierungsenergie hinzugefügt werden. Startet allerdings beim Zusammenführen der Edukte die Reaktion sofort bei den gegebenen Reaktionsbedingungen spricht man von einer spontanen Reaktion. Jede Reaktion hat eine für sie bei den vorliegenden Reaktionsbedingungen bestimmte Reaktionsgeschwindigkeit. Der Vorgang der Reaktion endet, wenn
- ein Chemisches Gleichgewicht erreicht ist oder
- eines, mehrere oder alle Edukte komplett umgewandelt worden sind.
Eine chemische Reaktion kann mit nur einem einzigen Edukt beginnen (siehe Abschnitt Zersetzungsreaktion) und auch mit nur einem Produkt enden. Gewöhnlich werden aber mindestens zwei Stoffe miteinander umgesetzt. D. h. eine chemische Reaktion erfolgt meistens mit zwei oder mehr Edukten wobei i. d. R. zwei oder mehr Produkte entstehen. Allerdings kann bei einer chemischen Reaktion aus mehr als einem Edukt auch nur ein einziges Produkt entstehen.
Der Ablauf chemischer Reaktionen wird in der Fachsprache als Reaktionsschema unter Angabe der Stoffnamen oder als Reaktionsgleichung durch Verwendung von Zahlen und chemischer Formelsymbole (siehe auch: Elementsymbol, chemische Formel) dargestellt:
Edukt (+ zweites Edukt + …) → Produkt (+ zweites Produkt + …)
Abgrenzung zu physikalischen Vorgängen
Bei einer chemischen Reaktion entsteht mindestens ein neuer Stoff (Produkt) - bei physikalischen Vorgängen ändern sich nicht die stoffspezifischen sondern nur physikalische Eigenschaften wie Wärmeinhalt, Aggregatzustand und Ausdehnung. Alle chemischen Reaktionen sind jedoch auch von physikalischen Veränderungen der Stoffe begleitet. Es sind z. B. die Abgabe oder Aufnahme von Energie und häufig Änderungen des Aggregatszustandes oder der Farbe beobachtbar.
Die Unterscheidung zwischen chemischer Reaktion und physikalischem Vorgang ist fließend:
- Die Auflösung von Natrium in verflüssigtem Ammoniakgas gilt als chemische Reaktion, da sich die Flüssigkeit blau färbt. Nach dem Eindampfen der blauen Flüssigkeit bleibt jedoch wieder Natrium übrig und nicht - wie im Fall einer chemischen Reaktion zu erwarten wäre - irgendeine Verbindung aus Natrium und Stickstoff.
- Die Auflösung von Kochsalz (Natriumchlorid) in Wasser wird häufig als physikalischer Lösevorgang eines Salzes bezeichnet. Die Flüssigkeit erfährt keine Veränderung in der Farbe, jedoch ändern sich deren Eigenschaften z. B. ist die Leitfähigkeit für Elektrizität in einer wässrigen Natriumchlorid-Lösung wesentlich höher als in reinem Wasser. Es werden unter Energieumsatz Ionenbindungen zerstört und Hydrathüllen erzeugt. Daher kann dieser Vorgang streng genommen ebenfalls den chemischen Reaktionen zugeordnet werden. Nach Eindampfender Flüssigkeit liegt wieder Kochsalz vor.
Unabhängig vom hier gesagten lassen sich Reaktionen jedoch auch mit physikalischen Mitteln beschreiben. Gegenstand der Untersuchung ist dann z.B. die Reaktionskinetik (Geschwindigkeit der Reaktion).
Reaktionsarten
Bei einer chemischen Reaktion werden chemische Stoffe in andere Stoffe mit anderen Eigenschaften umgewandelt. Eine Einteilung kann nach dem Aggregatzustand der beteiligten Stoffe erfolgen:
- Reaktionen in der Gasphase
- Reaktionen in Lösung
- Reaktionen in Schmelze
- Feststoffreaktionen
- Oberflächenreaktionen
oder nach der Art der reagierenden Teilchen:
- Ionenreaktionen
- Radikalreaktionen
- Molekülreaktionen
- Komplexbildungsreaktion
oder nach Ihr Reaktionsmechanismus:
- Stoffvereinigung (Synthese, Additionsreaktion)
- Stoffzerlegung (Analyse, Eliminierungsreaktion)
- Stoffumgruppierung (Austauschreaktionen):
- Redoxreaktion
- Säure-Base-Reaktion (Protolyse)
- Komplexbildungsreaktion (Ligandenaustausch)
- Fällungsreaktion (Niederschlagsbildung)
- organische Substitution (radikalisch, elektrophil, nukleophil)
Reaktionsgrundtypen
Je nach dem, ob Elemente oder Verbindungen bei den Edukten oder Produkten auftreten, unterscheidet man jedoch zunächst wenige Reaktionsgrundtypen. Alle anderen Reaktionsarten (Stoffumgruppierungen) lassen sich aus ihnen zusammensetzen:
Stoffvereinigung
Zwei Elemente treten zu einer Verbindung zusammen:
Der Vorgang wird auch Synthese oder Addition bezeichnet.
Sind die beiden Ausgangsstoffe identisch so spricht man von einer Dimerisierung:
Stoffzerlegung
Eine Verbindung wird in ihre Elemente zerlegt:
Der Vorgang wird auch als Analyse oder Zersetzungsreaktion genannt und kann durch verschiedene Energieformen erfolgen: Wird die Reaktion durch Erwärmung ausgelöst spricht man von Thermolyse, bei Bestrahlung von Photolyse und durch einen elektrischen Strom erzwungen von Elektrolyse.
Einfache Umsetzung
Hier reagiert ein Element mit einer Verbindung, wobei ein anderes Element und eine neue Verbindung entstehen:
Ein Beispiel wäre der Halogenidnachweis mit Chlorwasser und Hexan. Eine einfache Umsetzung kann man aus den beiden Teilreaktionen Stoffvereinigung und Stoffzerlegung zusammengesetzt vorstellen. Besonders in der organischen Chemie spricht man in dem Fall von einer Substitution.
Doppelte Umsetzung
Hier reagieren zwei Verbindungen so miteinander, dass zwei neue Verbindungen entstehen:
Eine doppelte Umsetzung kann man sich aus zwei Analyse- und zwei Synthesereaktionen zusammengesetzt vorstellen. Die doppelte Umsetzung wird auch Metathese genannt.
Ist das Produkt der Reaktion schwerlöslich, so spricht man von einer Fällungsreaktion. Ein Beispiel wäre der Halogenidnachweis mit Silbernitrat und Ammoniak.
Spezielle Reaktionstypen
Kondensation
- → Hauptartikel: Kondensationsreaktion
Bei Kondensationen treten zwei Moleküle zu einem einzigen zusammen und stoßen dabei kleine Moleküle wie Wasser oder Ammoniak ab. (Gegenteil: Hydrolyse)
Bei Polykondensationen und Polyadditionen reagieren viele kleine Moleküle (Monomere) zu Riesenmolekülen (Polymere). So entstehen z. B. aus Aminosäuren die Proteine (Eiweiße).
Eliminierung
- → Hauptartikel: Eliminierungsreaktion
Die Eliminierung ist ein Sammelbegriff aus der organischen Chemie für Reaktionen bei denen aus einem Molekül zwei Atome oder Atomgruppen abgespalten (eliminiert) werden. Damit eine Eliminierungsreaktion ablaufen kann, muss eine Base vorhanden sein. Die Eliminierung kann auch als Umkehr der Addition betrachtet werden.
Reaktionen nach Donator-Akzeptor-Prinzip
Säure-Base-Reaktionen, Redoxreaktionen und Komplexbildungsreaktionen lassen sich auf das Donator-Akzeptor-Prinzip zurückführen. In diesen Fällen entstehen die Produkte durch Austausch von Elementarteilchen zwischen den Edukten.
Säure-Base-Reaktionen
- → Hauptartikel: Säure-Base-Reaktion
 Zugabe von Ammoniakwasser zu Salzsäure: Hier reagieren die zwei Gase Chlorwasserstoff und Ammoniak zu Salmiaksalz-Rauch (Ammoniumchlorid) - eine Neutralisation
Zugabe von Ammoniakwasser zu Salzsäure: Hier reagieren die zwei Gase Chlorwasserstoff und Ammoniak zu Salmiaksalz-Rauch (Ammoniumchlorid) - eine NeutralisationDiese Reaktionen beruhen auf einem Austausch von Protonen zwischen den Edukten. Sie können als Sonderfall einer doppelten Umsetzung. angesehen werden. Als Edukte dienen stets eine Säure und eine Base. Die Säure als Protonendonator gibt dabei mindestens ein Proton an die Base als Protonenakzeptor ab.
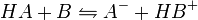
Säure + Base steht im Gleichgewicht zur konjungierten (korrespondierten) Base + konjungierten (korrespondierten) Säure Verdrängungsreaktionen
- → Hauptartikel: Verdrängungsreaktion
Die stärkere Säure (beziehungsweise Base) verdrängt die schwächere Säure (beziehungsweise Base) beziehungsweise deren gasförmiges Anhydrid aus deren Salzen. (Beispiele: Schwefelsäure setzt aus Sulfiten Schwefeldioxid und aus Chloriden Chlorwasserstoff frei, konzentrierte Chlorwasserstoffsäure setzt aus Sulfiden Schwefelwasserstoff und aus Cyaniden Cyanwasserstoff frei; Ätznatron setzt aus Aminen und Ammoniumverbindungen Ammoniak frei.
Redoxreaktionen
 Korrosion, ebenfalls eine Redoxreaktion
Korrosion, ebenfalls eine Redoxreaktion- → Hauptartikel: Redoxreaktion
Diese Reaktionen beruhen auf einem Austausch von Elektronen zwischen den Edukten. Sie können allen vier Grundformen chemischer Reaktionen zu Grunde liegen. Als Edukte dienen stets ein Reduktionsmittel und ein Oxidationsmittel. Das Reduktionsmittel als Elektronendonator gibt dabei mindestens ein Elektron an das Oxidationsmittel als Elektronenakzeptor ab.
Verbrennungen sind Redoxreaktionen, die stets elementaren Sauerstoff als Oxidationsmittel aufweisen. Bei der Gewinnung von Metallen aus Erzen wird als Reduktionsmittel Kohlenstoff oder Kohlenstoffmonoxid eingesetzt (siehe Eisengewinnung).
Komplexbildungsreaktionen
Eisensalze und deren Nachweise mit Blutlaugensalzen zum Komplex Berliner Blau- → Hauptartikel: Komplexbildungsreaktion
Bei einer Komplexbildung werden ebenfalls Elektronen ausgetauscht - hier allerdings werden sie einem Zentralatom (zumeist ein Kation als Lewis-Säure) von Molekülen oder Ionen in Form von freien Elektronenpaaren zur Verfügung gestellt (dem Liganden als Lewis-Base). Beispiele für Komplexbildungsreaktionen sind die klassischen Nachweisreaktionen. Auch in der Natur spiele Komplexe eine wichtige Rolle z.B. in Form des Blutfarbstoffes Hämoglobin und des für die Photosynthese wichtigen grünen Pflanzenfarbstoffes Chlorophyll.
Reversible Reaktionen
- → Hauptartikel Gleichgewichtsreaktion
Es gibt chemische Reaktionen, die nicht vollständig ablaufen. Auch wenn man die Edukte im stöchiometrischen Verhältnis mischt, liegen am Ende der Reaktion noch immer Edukte vor. Prinzipiell sind alle chemischen Reaktionen umkehrbar, die Produkte können wieder zu Edukten zurückreagieren. Die Reaktion von den Edukten zu den Produkten wird Hinreaktion, die von den Produkten zurück zu den Edukten Rückreaktion genannt.
In der Reaktionsgleichung wird die Reversibilität einer Reaktion durch den Gleichgewichtspfeil dargestellt:
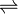 Die Definition der Hinreaktion entspricht der Leserichtung von links nach rechts. Die Rückreaktion entspricht dann der umgekehrten Leserichtung.
Die Definition der Hinreaktion entspricht der Leserichtung von links nach rechts. Die Rückreaktion entspricht dann der umgekehrten Leserichtung.Werden für reversible Reaktionen die Versuchsbedingungen nicht geändert, stellt sich nach einiger Zeit ein chemisches Gleichgewicht ein. Die Konzentrationen der Edukte und Produkte verändern sich nicht mehr, obwohl Hin- und Rückreaktion noch weiter ablaufen. Diese unveränderlichen Gleichgewichtskonzentrationen stehen in einem für die Reaktion und die Reaktionsbedingungen charakteristischen Verhältnis zu einander.
Bei scheinbar vollständig ablaufenden Reaktionen liegt das Gleichgewicht praktisch auf der Seite der Produkte. Die Hinreaktion ist begünstigt, die Rückreaktion läuft praktisch nicht ab. Für Edukte, die nicht miteinander reagieren, liegt das Gleichgewicht praktisch vollständig auf der Seite der Edukte.
Erhaltungssätze bei chemischen Reaktionen
- Erhaltung der Elemente: Edukte und Produkte enthalten dieselben Elemente. Es können keine Elemente entstehen oder verschwinden. (Dieser Erhaltungssatz wurde von Daniel Sennert 1618 formuliert. Er bedeutet eine Absage an den Anspruch der Alchemisten, aus nicht-goldhaltigen Stoffen Gold erzeugen zu können, sofern man dieses Vorhaben physikalisch versteht.)
- Das Gesetz von der Erhaltung der Masse: Die Summe der Masse der Edukte ist gleich der Summe der Masse der Produkte. (1. Grundgesetz der Chemie, Joachim Jungius, 1662 und Michail Wassiljewitsch Lomonossow, 1748).
- Beispiel: 1,00 g Eisen und 0.573 g Schwefel reagieren vollständig zu 1,573 g Eisensulfid (FeS).
- Das Gesetz der konstanten Proportionen besagt, dass chemische Verbindungen die Elemente in einem unveränderlichen, für die jeweilige Verbindung charakteristischen Massenverhältnis enthalten. (2. Grundgesetz der Chemie, Jeremias Benjamin Richter, 1792 und Joseph-Louis Proust, 1799).
- Beispiel: Bei der Reaktion von Eisen mit Schwefel zu Eisensulfid reagiert nur ein Gemisch von Eisen und Schwefel im Massenverhältnis 1 : 0.573 vollständig. Bei Eisendisulfid (Eisenkies) beträgt das Massenverhältnis 1 : 1.146.
- Das Gesetz der multiplen Proportionen besagt, dass sich in verschiedenen Verbindungen, die aber dieselben Elemente enthalten, die Massenverhältnisse selbst im Verhältnis ganzer Zahlen stehen. (3. Grundgesetz der Chemie, John Dalton, 1808)
- Beispiel: Das Massenverhältnis vom Schwefel im Eisensulfid (0.573) verhält sich zum Massenverhältnis vom Schwefel im Eisendisulfid (1.146) wie 2 : 1
Folgerungen hieraus:
- Das Prinzip der konstanten Volumenproportionen (auch Gesetz von Gay-Lussac) besagt, dass bei Reaktionen in der Gasphase die Volumina der Edukte zu den Volumina der Produkte im Verhältnis ganzer Zahlen stehen. (abgeleitet aus dem 2. und 3. Grundgesetz der Chemie und dem Gesetz von Avogadro über konstante Molvolumina, Joseph Louis Gay-Lussac und Alexander von Humboldt, 1808)
- Beispiel: Bei der Synthese von Ammoniak aus den Elementen stehen die Volumina von Stickstoff, Wasserstoff und Ammoniak im Verhältnis 1 : 3 : 2.
- Edukte und Produkte enthalten dieselbe Anzahl an Elementatomen (vgl. 1. und 2. Grundgesetz der Chemie). Dies wird in einer Reaktionsgleichung bei gegebenen Formeln der Stoffe durch geeignete Wahl stöchiometrischer Koeffizienten erreicht. Während einer chemischen Reaktion gehen Atome weder kaputt, gehen verloren, kommen neue dazu oder werden in Atome anderer Elemente umgewandelt. Es erfolgt nur eine Umgruppierung der Atome
- Die Summe der elektrischen Ladungen der Edukte ist gleich der Summe der elektrischen Ladungen der Produkte (Ladungsausgleich oder Ladungserhaltung). Während chemischen Reaktionen gehen also auch nicht Elektronen verloren oder es kommen welche dazu. In Protolysen gehen auch keine Wasserstofkationen (Protonen) verloren.
Energetische Betrachtungen
Jede chemische Reaktion läuft unter Energiebeteiligung ab, da das Lösen und Knüpfen chemischer Bindungen mit Energieumwandlungen verbunden ist.
Beteiligte Energieformen
Auf Grund der Art der beteiligten Energie lassen sich verschiedene Reaktionstypen unterschieden:
- Bei thermochemischen Reaktionen wird aus der Umgebung Wärme aufgenommen (ein Beispiel für endotherme Reaktionen) oder an die Umgebung abgegeben (ein Beispiel für exotherme Reaktionen).
- Beispiele für exotherme Reaktionen: Die Synthese von Wasser in der Knallgasreaktion setzt unter Standardbedingungen 242 kJ pro Mol an (Redoxreaktions-)Energie frei - bei modernen Sprengstoffen kann das wesentlich mehr sein.
- Beispiele für endotherme Reaktionen: Michael Faraday zerlegte Wasser in seine Elemente, indem er Wasserdampf durch glühende Eisenrohre leitete, Harold Urey ließ aus einem reduzierenden Gasgemisch durch Energiezufuhr organische Moleküle entstehen.
- Die Elektrochemie beschäftigt sich mit Reaktionen, die unter Beteiligung elektrischer Energie ablaufen (siehe Elektrolyse, Galvanische Zelle, Batterie, Akkumulator, Brennstoffzelle, Galvanoplastik).
- Photochemische Reaktionen werden entweder durch Licht ausgelöst (Beispiele: Photosynthese, Bromierung von Alkanen, Aushärten von Kunststoffen durch UV-Licht in der Zahntechnik) oder sie laufen unter Lichterscheinung ab (Beispiel: Luminol-Reaktion)
- Manche Reaktionen lassen sich auch mechanisch auslösen, wie zum Beispiel die Zersetzung von TNT. Häufig wird hierbei die mechanische Arbeit in Wärmeenergie umgewandelt, die dann eigentlich die Reaktion auslöst.
Reaktionsweg und Energiebilanz
Die Thermodynamik einer Reaktion beschreibt den Ablauf einer Reaktion aus energetischer Sicht.
Ein chemisches System ist bestrebt, einen möglichst energiearmen Zustand (Enthalpie-Minimum) und einen möglichst hohen Unordnungsgrad (Entropie-Maximum) einzunehmen.
Wenn Energie im Verlauf der Reaktion frei wird, spricht man von einem exothermen Vorgang. Wird Energie im Reaktionsverlauf aufgenommen, so handelt es sich um eine Endotherme Reaktion. Die Energie, die aufgebracht werden muss um eine Reaktion zu starten, wird Aktivierungsenergie genannt. Ob eine Reaktion freiwillig abläuft oder nicht wird den Fachbegriffen Exergone und endergone Reaktion bezeichnet.
Katalyse
Durch Einsatz von Katalysatoren kann die Aktivierungsenthalpie sowohl bei endothermen als auch bei exothermen Reaktionen gesenkt werden. Bei der Autokatalyse wirken die entstehenden Produkte als Katalysatoren für ihre Bildung.
Beispiel: Autokatalytische Bildung von Silber im Entwicklerbad, siehe dazu Fotografie.
![\mathrm{Ag^+ + e^- \xrightarrow{[Ag]} \ Ag}](/pictures/dewiki/52/42484a899327186adafcd150421221b8.png)
Endergone und exergone Reaktionen
Wird bei einer Reaktion die Entropie mit einbezogen, wird für energetische Betrachtungen die Gibbs-Helmholtz-Gleichung benötigt:
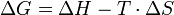
T = Temperatur in Kelvin
ΔG = Änderung der freien Enthalpie
ΔS = Entropieänderung (bei 298 K) aus ΔS = Σ{S(Produkte)} - Σ{S(Edukte)}
ΔH = Enthalpieänderung (bei 298 K) aus ΔH = Σ{H(Produkte)} - Σ{H(Edukte)}Bei endergonen Reaktionen ist ΔG positiv, bei exergonen Reaktionen ist ΔG negativ.
Eine chemische Reaktion läuft nur dann von selbst ab, wenn die freie Reaktionsenthalpie ΔG negativ ist.
Interpretationsmöglichkeiten der freien Enthalpie:
- Sie ist ein Maß für die Stabilität eines chemischen Systems.
- Sie ist ein Maß für die „Freiwilligkeit“ oder „Treibkraft“ einer Reaktion; mit ihrer Hilfe lässt sich entscheiden, ob eine Reaktion (nach eventueller Aktivierung) ohne weitere Energiezufuhr ablaufen kann.
- Sie ist die für Lebewesen maximale nutzbare Energie.
Statistische Betrachtungen
- → Hauptartikel: Reaktionskinetik
Manche chemische Reaktionen laufen nur sehr langsam oder gar nicht ab, obwohl sie aus thermodynamischer Sicht möglich wären. Durch geeignete Reaktionsbedingungen lässt sich aber auch diese Reaktionsgeschwindigkeit erhöhen.
- Erhöhung des Zerteilungs- und Durchmischungsgrades und damit Vergrößerung der reaktiven Oberfläche bei Festkörperreaktionen. Beispiel: Die Verbrennung eines Kohlestückes dauert länger als die Verbrennung derselben Menge Kohlepulver, das in einen Luftstrom geblasen wird.
- Erhöhung der Konzentration der Reaktionspartner. Beispiel: Kohlenstoff verbrennt in reinem Sauerstoff schneller als in derselben Menge Luft.
- Erhöhung der Temperatur, deren Abhängigkeit der Reaktionsgeschwindigkeit durch die Arrhenius-Gleichung beschrieben wird
Die kinetische Gastheorie stellt einen wichtigen Beitrag zur Modellierung der Bedingungen einer chemischen Reaktion auf der Ebene der kleinsten Teilchen dar.
- Edukt-Teilchen werden nur dann in Produkt-Teilchen umgewandelt, wenn sie mit genügend hoher Energie zusammenstoßen. Bei großen Molekülen muss der Zusammenstoß auch an der richtigen Stelle erfolgen. (So muss ein Substrat-Molekül genau die Substratbindungstelle seines Enzyms treffen. An anderer Stelle des Enzyms wäre auch bei genügend hoher Energie keine Reaktion möglich.)
- Nicht alle Teilchen haben dieselbe Energie, so dass es in einem Reaktionsgemisch auch zu Zusammenstößen zwischen Teilchen mit zu niedriger Energie kommt. Es erfolgt keine Reaktion, sondern nur ein elastischer Stoß.
- Ob und wie schnell eine Reaktion abläuft, ist von der Wahrscheinlichkeit abhängig, mit der Eduktteilchen, die die notwendige Mindest-Energie oder mehr aufweisen, zusammentreffen.
Möglichkeiten zur Erhöhung der Wahrscheinlichkeit eines „erfolgreichen“ Zusammenstoßes:
- Temperaturerhöhung: Je höher die Temperatur ist, umso mehr Teilchen weisen die erforderliche Mindestenergie oder mehr auf. Eine Abschätzung kann mit der RGT-Regel erfolgen.
- Konzentrationserhöhung: Je höher die Konzentration der Reaktionspartner ist, desto wahrscheinlicher ist es, dass Teilchen mit der passenden Energie zusammentreffen.
Da im Laufe der Reaktion die Konzentration der Edukte abnimmt und die Konzentration der Produkte zunimmt, nimmt die Reaktionsgeschwindigkeit mit der Zeit ab. Die Optimierung dieser Reaktionsbedingungen hat besonders im industriellen und großtechnischen Maßstab eine herausragende Bedeutung.
Weiterführende Themen
- Theorie des Übergangszustandes (Übergangszustand)
- Kolmogorov-Gleichung zur mathematischen Beschreibung chemischer Reaktionen mit Diffusions- und Sättigungsterm
Listen
- Liste der organischen Reaktionen (Einteilung nach entstehender Bindung)
- Liste von Nachweisreaktionen
- Liste von Namensreaktionen
Literatur
- Eckhard Ignatowitz, Gerhard Haering: Chemie für Schule und Beruf, S. 22ff und S. 41ff; Europa-Lehrmittel, Haan-Gruiten; ISBN 3-8085-7054-7
- Michael Wächter: Stoffe, Teilchen, Reaktionen. Verlag Handwerk und Technik, Hamburg 2000, S.154-169 ISBN 3-582-01235-2
Einzelnachweise
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A.Wilkinson. Blackwell Scientific Publications, Oxford (1997) doi:10.1351/goldbook.C01033
Weblinks
Wikimedia Foundation.

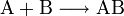
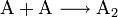
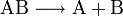


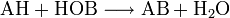
_(III).JPG)